恒温恒容时,NO2和N2O4之间发生反应N2O4(g)  2NO2(g),如图所示。
2NO2(g),如图所示。
(1)曲线________(填“X”或“Y”)表示NO2的物质的量随时间变化的曲线。
(2)若升高温度,则v(正)________,v(逆)________(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3 mol·(L·min)-1,乙中v(N2O4)=0.2 mol·(L·min)-1,则________容器中反应更快。
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应: 3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c (A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c (A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)= n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示:
(1)该反应的化学方程式为 ;
(2)下列表示该反应速率最大的是
A.v(X)=0.6mol/(L·s) B.v(Y)=0.3mol/(L·s) C.v(Z)=0.5mol/(L·s)
(1) 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图, 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。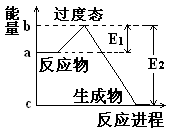
(2)在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
(1)在一密闭的2 L的容器里充入8 mol SO2和4 mol18O2,在一定条件下开始反应:
2SO2(g)+O2(g) 2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
①反应后18O原子存在于哪些物质中________
②2 min末SO3的浓度为________
③用O2的浓度变化表示该时间段内的化学反应速率为________
(2)基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
①可以用来鉴别苯蒸气和乙烯的试剂是________(填序号)
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液 D.氢气
②苯分子具有平面正六边形结构,所有原子共平面,则苯分子中在一条直线上的原子最多有________个
(3)下列营养物质在人体内发生的变化及其对人的生命活动所起的作用不正确的是
A.人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量
B.淀粉和纤维素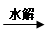 葡萄糖
葡萄糖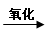 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂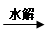 甘油和高级脂肪酸
甘油和高级脂肪酸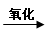 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质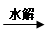 氨基酸
氨基酸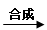 人体所需的蛋白质(人体生长发育、新陈代谢)
人体所需的蛋白质(人体生长发育、新陈代谢)
分一定温度下,在容积为VL的密闭容器中进行反应:aN(g) bM(g),N、M的物质的量随时间的变化曲线如图所示:
bM(g),N、M的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中 =________。
=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________。
(3)下列叙述中能说明上述反应达到平衡状态的是________。
A 反应中M与N的物质的量之比为1:1
B 混合气体的总质量不随时间的变化而变化
C 混合气体的总物质的量不随时间的变化而变化
D 单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应: xA(g)+yB(g)  pC(g)+qD(g)已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。回答下列问题:
pC(g)+qD(g)已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。回答下列问题:
(1)反应2min内,VA = ;
(2)化学方程式中,x= 、y= 、p= 、q= ;
(3)如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”)
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由 是 ;
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时_______(填“增大”“减小”或“相等”)。
某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ________________ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。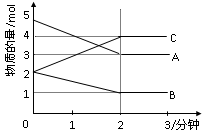
(6分) 在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应,10分钟时达到平衡: 2SO2 + O2 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求:
(1)10分钟时O2的反应速率为 mol/(L·min)(2)平衡时SO2的转化率
(3) 平衡常数K为多少
(6分)一定温度下,在容积为VL的密闭容器里进行反应:aN(g) bM(g),M.N的物质的量随时间的变化曲线如图所示:
bM(g),M.N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中a∶b = 。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为: 。
(3)下列叙述能说明上述反应达到平衡状态的是(填序号) 。
A反应中M与N的物质的量之比为1:1
B混合气体的总质量不随时间的变化而变化
C混合气体的总物质的量不随时间的变化而变化
D单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g) 2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2 ②各组分的物质的量浓度不再改变
③体系的压强不再发生变化 ④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)= V(NH3逆)
⑦单位时间内3 mol H—H键断裂的同时2 mol N—H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2)向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下图所示。已知在反应过程中混合气体的平均分子量没有变化。请回答:
①密闭容器的体积是 L。
②若t1=15s时,则t0-t1阶段以C物质浓度变化表示的反应速率为v(C)= 。
③写出反应的化学方程式: 。
④B的起始物质的量是 。
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。若1g水蒸气转化为液态水放热2.44kJ,则反应2H2(g)+O2(g) =2H2O(l) △H= kJ∙mol-1。
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。

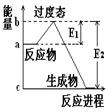
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________(选填“吸热”或“放热”)反应,写出反应的热化学方程式 。
(3)该反应平衡常数K为___________,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”)
(4)恒容条件下,下列措施中能使 增大的有
增大的有
a.升高温度 b.充入He气
c.再充入2 molH2 d.使用催化剂
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有 (填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是 。
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是 (填字母)。
A升高温度 B降低温度 C增大压强
D减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为 mol•L-1•min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 |
n(甲) |
n(C) |
n (D) |
v正与v逆的关系 |
| Ⅰ |
0.20 |
0.10 |
0.20 |
v正=v逆 |
| Ⅱ |
0.20 |
0.40 |
1.00 |
②? |
| Ⅲ |
0.60 |
1.20 |
0.80 |
③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格: ② ③
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含 量和温度的关系如图所示,根据右图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含 量和温度的关系如图所示,根据右图回答下列问题: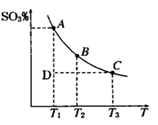
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
A体系的密度不发生变化 B SO2与SO3的体积比保持不变
C体系中硫元素的质量百分含量不再变化 D单位时间内转移4 mol 电子,同时消耗2 mol SO3
E.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。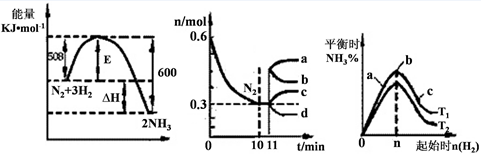 图1 图2 图3
图1 图2 图3
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
试题篮
()