某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 。
(忽略温度对反应速率的影响)
“碘钟”实验中,3I-+S2O===I+2SO的反应速率可以用I与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/(mol·L-1) |
0.040 |
0.080 |
0.080 |
0.160 |
0.120] |
| c(S2O)/(mol·L-1) |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该 实验的目的是_____________________________________________________。
实验的目的是_____________________________________________________。
(2)显色时间t1=____________________________ (3)温度
(3)温度 对该反应的反应速度的影响符合一般规律,若在40℃下进行编号③对应浓度的
对该反应的反应速度的影响符合一般规律,若在40℃下进行编号③对应浓度的 实验,显色时间t2的范围为__________(填字母)。
实验,显色时间t2的范围为__________(填字母)。
| A.<22.0 s | B.22.0 s~44.0 s |
| C.>44.0 s | D.数据不足,无法判断 |
(4)通过分析比较上表数据,得到的结论是____________。
草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ — Mn2++ CO2↑+ H2O(未配平)
现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| I |
2 mL |
20 |
|
| II |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| III |
2 mL |
30 |
|
| IV |
1 mL |
20 |
1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(3)对比实验I和IV,可以研究 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。
某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
| 4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
反应结束 |
| 2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
| 4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比较连续的气泡 |
请回答:
(1)写出铝与盐酸反应的离子方程式 .
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是 .
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出你的假设(写出2种可能):
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃).请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50.0mL、铝为9.0g过量):
| 实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L﹣1 |
| 1 实验①和②探究盐酸浓度对该反应速率的影响; 2实验①和③探究温度对该反应速率的影响; 3实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响. |
① |
25˚C |
铝片 |
4.0 |
| ② |
|
|
|
|
| ③ |
|
|
|
|
| ④ |
|
|
|
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间。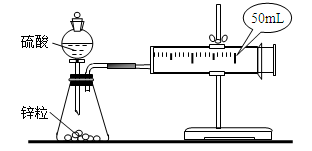
(1)当收集到10mL H2时,哪个实验所耗时间较长?为什么?
_________________________________________________________________________________
(2)活塞外移的情况是_______________。
| A.均匀外移 | B.先快后慢 | C.先慢后快 | D.先慢后快然后又逐渐减慢 |
你选择的理由是___________________________________________________________。
某学生小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.00 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 编号 |
T/K |
大理石规格 |
HNO3浓度 / mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(I)实验①和②探究HNO3浓度对该反应速率的影响; |
| ② |
298 |
粗颗粒 |
|
(II)实验①和③探究_________对该反应速率的影响; (Ⅲ)实验①和________探究大理石规格(粗、细)对该反应速率的影响。 |
| ③ |
308 |
粗颗粒 |
2.00 |
|
| ④ |
298 |
|
2.00 |
(2)实验①中CO2的物质的量随时间变化的关系见图:
计算在70—90 s范围内HNO3的平均反应速率(忽略溶液体积变化)。
某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3名称为硫代硫酸钠,俗称海波,可以看成是用一个S原子取代了Na2SO4中的一个O原子而形成。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究验证自己的预测。
[提出假设]
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH 7(填“>”、“=”或“<”)
(2)部分学生从S元素化合价推测Na2S2O3与SO2性质相似,均具有较强的 。
[实验探究]
取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写下表中空格)。
[实验结论]
(6)探究①: 。
(7)探究②: 。
[问题讨论]
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是
。
把在空气中久置的铝片5.0 g投入盛有 500mL0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因___________,
有关反应的离子方程式为____________ ;
(2)曲线由a→b段产生氢气的速率较慢的原因___________
有关的化学方程式__________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,某探究小组用KMnO4酸性溶液与H2C2O4(草酸)溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol· L—1、0.0010 mol· L—1,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol· L—1)的用量均为2 mL。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
催化剂的用量 / g |
酸性KMnO4溶液的浓度/mol·L-1 |
实验目的 |
| ① |
298 |
0.5 |
0.010 |
a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究温度对反应速率的影响; c. 实验①和④探究催化剂对反应速率的影响。 |
| ② |
|
|
|
|
| ③ |
|
|
|
|
| ④ |
|
|
|
(2)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 |
溶液褪色所需时间 t / min |
||
| 第1次 |
第2次 |
第3次 |
|
| ① |
14.0 |
13.0 |
11.0 |
| ② |
6.5 |
6.7 |
6.8 |
则实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):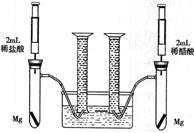
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为____________________。
(2)在上述实验方案中有一明显欠缺,该欠缺是____________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是____________;最终产生氢气体积的关系应是_______________。
(4)实验中产生的氢气体积比理论值高,可能原因是_______________________。
(5)通过比较起始反应的速率可以得出的结论是______________。
(6)除上述方法外,还可以通过其他方向比较盐酸和醋酸的酸性,请写出其中的一种方法_________。
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)实验室中现有、
、
、
等4种溶液,可与实验中
溶液起相似作用的是;
(4)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
||||||
| 4 |
30 |
|||||
| 饱和 |
0 |
0.5 |
2.5 |
5 |
20 |
|
| 10 |
0 |
①请完成此实验设计,其中:1=,
6=,
9=;
②反应一段时间后,实验中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量溶液时,生成氢气的速率会大大提高。但当加入的
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
控制反应条件可改变化学反应速率。
(1)使用催化剂是改变化学反应速率的一种方法,例如H2O2在MnO2作用下分解,请写出该反应的化学方程式:_____________________________。
(2)经研究发现Fe3+和Cu2+对H2O2的分解也具有催化作用。
某研究小组为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验,请将他们的实验方案补充完整:
实验目的:_________________________________-
实验试剂:5%H2O2溶液,0.1mol/LFeCl3溶液,0.1mol/LCuSO4溶液
实验仪器:试管、胶头滴管
实验步骤:取两支试管各加入1mL5%H2O2溶液,分别滴加两滴0.1mol/LFeCl3溶液、0.1mol/LCuSO4溶液。
该小组的同学可通过观察______________________以比较出Cu2+和Fe3+的催化效果。
问题与讨论:有同学提出将FeCl3改为Fe2(SO4)3更合理,你认为他的理由是____________________________________________________。
(3)影响化学反应速率的因素除催化剂外,还有______________(答出一种即可),并举一例生产、生活实例加以说明:__________________________。
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如下图象。请回答: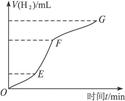
(1)分析判断,_____________段化学反应速度最快,原因可能是___________________;
FG段化学反应速率较慢的原因可能是____________________________________________。
(2)为了降低该反应的反应速率,你认为可以采取哪些措施_________________(至少说出两种)。
试题篮
()