下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L盐酸与锌反应时,加入100 mL氯化钠溶液,生成氢气的速率不变 |
B.对于可逆反应2CO+2NO N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 |
| C.二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减慢 |
| D.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生 |
实验室用3.0 mol·L-1的硫酸溶液与锌粒反应制取氢气。下列措施中可能加大反应速率的是
| A.适当降低温度 | B.将锌粒改为锌粉 |
| C.将所用硫酸换成98%的浓硫酸 | D.加入少量醋酸钠固体 |
在C(s)+CO2(g) 2CO(g)反应中可使反应速率增大的措施是
2CO(g)反应中可使反应速率增大的措施是
①减小容器体积增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
| A.①③⑤ | B.②④ | C.①③ | D.③⑤ |
镁是生产铝合金必需的添加材料。镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域。现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示。在下列因素中对产生H2速率有影响的是
| A.镁条的质量 | B.镁条的表面积 |
| C.Cl-的浓度 | D.压强 |
两只敞口烧杯中分别发生如下反应:一只烧杯中反应为:A+B=C+D,反应温度为T1,另一只烧杯中反应为:M+N=P+Q,反应温度为T2,T1>T2,则两只烧杯中反应速率快慢为
| A.前者快 | B.后者快 | C.一样快 | D.无法确定 |
某一化学反应在不同催化剂条件下的能量变化曲线如图所示。下列说法正确的是
| A.化学催化比酶催化的效果好 |
| B.反应物总能量低于生成物总能量 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.使用不同催化剂可以改变反应的反应热 |
下列措施肯定能使化学反应速率增大的是
①增大反应物的量 ②减小压强 ③升高温度 ④使用正催化剂
| A.①②③ | B.③④ | C.②③④ | D.①②③④ |
下列有关反应速率的说法正确的是
| A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 |
| B.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 |
| D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 |
反应A(s)+B(g)=c(g)在密闭容器中进行,下列情况不能使反应速率加快的是
| A.升高温度 | B.增加A的物质的量 |
| C.使用催化剂 | D.缩小容器体积使压强增大 |
硫代硫酸钠溶液与稀硫酸反应:Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓ + H2O
下列各组实验中最先出现浑浊的是
| 实验 |
反应温度 /℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V / mL |
c /(mol·L-1) |
V /mL |
c /(mol·L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
| D |
35 |
5 |
0.2 |
10 |
0.2 |
5 |
下列说法中正确的有的是
| A.决定化学反应速率的主要因素是参加反应的物质的性质 |
| B.催化剂可以使不起反应的物质发生反应 |
| C.可以找到一种催化剂使水变成汽油 |
| D.催化剂是决定化学反应速率的主要因素 |
取两份10mL 1 mol·L-1稀盐酸,向其中一份中加入过量的锌粒,得到气体的体积随时间变化如b所示,向另一份中加入过量的锌粒同时加入另一种物质,
得到气体的体积如a所示,则另一种物质是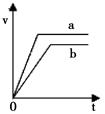
| A.铝粉 | B.3 mol·L-1稀硫酸 |
| C.铁粉 | D.氢氧化钠固体 |
下列四支试管中,双氧水分解的化学反应速率最大的是
| 试管 |
温度 |
过氧化氢浓度 |
催化剂 |
| A |
室温(25℃) |
12% |
MnO2 |
| B |
室温(25℃) |
4% |
无 |
| C |
水浴加热(50℃) |
12% |
无 |
| D |
水浴加热(50℃) |
12% |
MnO2 |
已知C(s)+CO2(g) 2CO(g)正反应方向是吸热过程,下列可使正反应速率增大的措施是
2CO(g)正反应方向是吸热过程,下列可使正反应速率增大的措施是
①减小容器体积使增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
⑥降低温度
| A.①③⑤ | B.②④ | C.①③ | D.①③⑥ |
试题篮
()