下列物质都能与金属钠反应放出H2,产生H2的速率排序正确的是
①C2H5OH ②NaOH溶液 ③醋酸溶液
| A.③﹥②﹥① | B.②﹥①﹥③ | C.①﹥②﹥③ | D.③﹥①﹥② |
已知反应A2(g)+2B2(g)  2AB2(g);△H<0,下列说法正确的是
2AB2(g);△H<0,下列说法正确的是
| A.升高温度,正反应速率增加,逆反应速率减小 |
| B.达到平衡后,增大A2的浓度,平衡向逆反应方向移动 |
| C.达到平衡后,升高温度或减小压强,平衡向正反应方向移动 |
| D.达到平衡后,降低温度或减小压强,平衡向正反应方向移动 |
把下列四种x的溶液,分别加入盛有10 mL、2 mol/L的盐酸的烧杯中,并均加水稀释至50mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是:
| A.20 mL,2 mol/L | B.20 mL,3 mol/L | C.10 mL,5 mol/L | D.10 mL,3 mol/L |
常温下,0.2 mol·L-1的盐酸30mL分别与下列Na2CO3溶液混合,再加水稀释到100mL,其中最初产生CO2的速率最快的是
| A.20mL0.3 mol·L-1Na2CO3 | B.10mL0.4 mol·L-1Na2CO3 |
| C.25mL0.4 mol·L-1Na2CO3 | D.15mL0.5 mol·L-1Na2CO3 |
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
| A.降低温度 | B.恒容充入氮气 | C.恒压充入氦气 | D.恒容充入氦气 |
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C.“纳米铜”与铜是同素异形体 |
| D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |
在生活、生产中为增大反应速率而采取的措施合理的是
| A.食物放在冰箱中 |
| B.塑料制品中添加抑制剂 |
| C.在糕点包装内放置小包除氧剂 |
| D.燃煤发电时用煤粉代替煤块 |
下列四种X溶液,均能跟盐酸反应,其中反应最快的是
| A.10℃ 20mL 3mol/L的X溶液 | B.20℃ 30mL 2molL的X溶液 |
| C.20℃ 10mL 4mol/L的X溶液 | D.10℃ 10mL 2mol/L的X溶液 |
决定化学反应速率的主要因素是
| A.参加反应的物质本身的性质 | B.催化剂 |
| C.温度、压强以及反应物的接触面 | D.反应物的浓度 |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)  MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是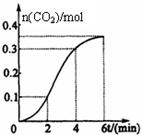
| A.反应开始2分钟内平均反应速率最大 |
| B.反应4分钟后平均反应速率最小 |
| C.反应开始4分钟内温度对反应速率的影响比浓度大 |
| D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有:
①降温;②把镁条粉碎;③加入蒸馏水使盐酸变稀;④升温
| A.①② | B.②③ | C.①③ | D.②④ |
试题篮
()