已知:2CH3OH(g) CH3OCH3(g)+H2O(g) △H=" -25" kJ•mol-1。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表,下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) △H=" -25" kJ•mol-1。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表,下列说法中不正确的是( )
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/(mol•L-1) |
0.08 |
1.6 |
1.6 |
A.此时刻反应达到平衡状态
B.容器内压强不变时,说明反应达平衡状态
C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D.平衡时,反应混合物的总能量降低40kJ
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) ΔH<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2C(g) ΔH<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
| A.0~t2时,v(正)>v(逆) |
| B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ |
| C.t2时刻改变的条件是向密闭容器中加C |
| D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ |
合成氨反应:N2(g)+3H2(g)  2NH3(g) ΔH =-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) ΔH =-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:

下列说法正确的是
| A.t1时升高了温度 | B.t2时使用了催化剂 |
| C.t3时增大了压强 | D.t4时降低了温度 |
已知2H2O2  2H2O+ O2↑,若其他条件不变,下列措施不能使该反应速率增大的是( )
2H2O+ O2↑,若其他条件不变,下列措施不能使该反应速率增大的是( )
| A.降低温度 |
| B.加入少量MnO2 |
| C.加入少量FeCl3 |
D.增大H2O2的浓度 |
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率增大的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率增大的是
| A.增加C的量 | B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2 | D.保持压强不变,充入N2 |
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
| A.③⑦⑧ | B.③⑤⑧ |
| C.①⑥⑦ | D.⑤⑦⑧ |
下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
四个体积相同的密闭容器中,在一定条件下,发生如下反应:N2+3H2 2NH3,化学反应速率最小的是
2NH3,化学反应速率最小的是
| 容器 |
温度(℃) |
N2(mol) |
H2(mol) |
催化剂 |
| A |
500 |
1 |
3 |
有 |
| B |
500 |
0.5 |
1.5 |
有 |
| C |
450 |
1 |
3 |
无 |
| D |
450 |
0.5 |
1.5 |
无 |
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
| A.使用合适的催化剂可以加大反应速率 |
| B.升高温度可以增大反应速率 |
| C.增大N2浓度可以使H2转化率达到100℅ |
| D.增大N2浓度可以增大反应速率 |
下列说法不正确的是
| A.探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合 |
| B.用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值 |
| C.H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
| D.欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)分别为中和滴定实验和pH试纸 |
在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) CO2(g)+N2(g),平衡状态时NO(g)的物质的量溶液c(NO)与温度T的关系如下图所示,则下列说法中,正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量溶液c(NO)与温度T的关系如下图所示,则下列说法中,正确的是( )
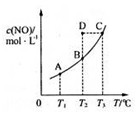
| A.该反应的△H>0 |
| B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
| C.在T2时,若反应体系处于状态D,则这时一定有v正<v负 |
| D.在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C |
一定条件下,可逆反应C(s)+CO2(g) 2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
| A.①②③④ | B.①③ | C.①② | D.①③④ |
已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是
| 组号 |
反应 温度/℃ |
Na2S2O3 |
H2SO4 |
H2O |
||
| 体积/ mL |
浓度/ mol·L-1 |
体积/ mL |
浓度/ mol·L-1 |
体积/ mL |
||
| A |
10 |
5 |
0.2 |
5 |
0.1 |
10 |
| B |
10 |
5 |
0.1 |
5 |
0.1 |
10 |
| C |
30 |
5 |
0.1 |
5 |
0.1 |
10 |
| D |
30 |
5 |
0.2 |
5 |
0.2 |
10 |
一定量的Fe与过量的稀硫酸反应,为了减缓反应速率又不影响生成氢气的总量,不可以采取的措施是
| A.加入K2SO4溶液 |
| B.加入CH3COONa固体 |
| C.加一定量水 |
| D.加入KNO3溶液 |
在相同的温度与体积下,对反应CO2(g) + H2(g)  CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| |
CO2 |
H2 |
CO |
H2O |
| 甲 |
amol |
amol |
0mol |
0mol |
| 乙 |
2amol |
2amol |
0mol |
0mol |
| 丙 |
2amol |
2amol |
amol |
amol |
| 丁 |
amol |
0mol |
2amol |
2amol |
上述四种情况,起始的时候正反应速率 (H2)正大小顺序正确的是
(H2)正大小顺序正确的是
A.丙>丁>乙>甲 B.丙>乙=丁>甲 C.丙>乙>甲>丁 D.乙=丙>甲>丁
试题篮
()