氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)  F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)  H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
| A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
B.水电离的热化学方程式为:H2O(1)  H+(aq)+OH—(aq);△H= +57.3kJ/mol H+(aq)+OH—(aq);△H= +57.3kJ/mol |
| C.当c > 0.1时,一定不存在:c(Na+) = c(F—) |
| D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1 |
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 |
AgCl |
Ag2CrO4 |
CH3COOH |
HClO |
H2CO3 |
| KSP或Ka |
KSP=1.8×10-10 |
KSP=2.0×10-12 |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
已知25℃时,CaSO4在水中沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是
| A.溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大 |
| B.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)较原来大 |
| C.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
已知四种盐的溶解度(S)曲线如右图所示,下列说法不正确的是
| A.将NaCl溶液蒸干可得NaCl固体 |
| B.将MgCl2溶液蒸干可得MgCl2固体 |
| C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 |
| D.可用MgCl2和NaClO3制备Mg (ClO3)2 |
下列有关叙述正确的是
| A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
Ag2S中混有少量AgCl,可以把该混合物加入以下哪种溶液中除去AgCl ( )
| A.盐酸 | B.NaOH溶液 | C.Na2S溶液 | D.H2SO4溶液 |
下列各组中的比值等于2:1的是( )
| A.pH为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 |
| B.K2S溶液中c(K+)与c(S2-)之比 |
| C.相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比 |
| D.10mL0.5mol/L的盐酸与5mL0.5mol/L的盐酸溶液中的c(H+)之比 |
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.该体系中有CaF2沉淀产生 |
C.该体系中KSP(CaF2)= |
D.KSP(CaF2)随温度和浓度的变化而变化 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3 主要:Cu2+ + CO32─+ H2O ="=" Cu(OH)2↓+ CO2↑
次要:Cu2+ + CO32─="=" CuCO3↓
(2) CuSO4 +Na2S 主要:Cu2+ + S2─="=" CuS↓
次要:Cu2+ + S2─+ 2H2O ="=" Cu(OH)2↓+ H2S↑
下列几种物质的溶解度大小的比较中,正确的是 ( )
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42× 10-11。下列说法正确的是( )
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01mol/L NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2 |
某温度下,水的离子积常数K 。该温度下,将pH=4的
。该温度下,将pH=4的 溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
| A.1∶10 | B.9∶1 | C.1∶9 | D.99∶21 |
下列关于电解质溶液的叙述正确的是( )
| A.中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1∶2 |
| B.pH=13的氨水加水稀释后,溶液中所有离子的浓度均降低 |
| C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| D.0.1 mol·L-1的硫酸铵溶液中,离子浓度大小顺序为: |
c(NH4+)>c(SO42-)>c(H+) >c(OH-)
向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况。则下列叙述正确的是
| A.溶液的pH增大 | B.溶液的pH减小 |
| C.溶液中Ca2+浓度保持不变 | D.溶液中Ca2+物质的量保持不变 |
常温下,AgCl、AgBr、AgI的溶度积(Ksp)依次为1.8×10 、5.0×10
、5.0×10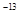 、8.3×10
、8.3×10 。下列有关说法错误的是 ( )
。下列有关说法错误的是 ( )
| A.常温下在水中溶解能力AgCl>AgBr>Agl |
| B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成 |
| C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCI沉淀生成 |
| D.在AgI饱和液中加入NaI固体有AgI沉淀析出 |
已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+) c(OH-)。
试题篮
()