将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的叙述错误的是
| A.Oa段反应的化学方程式是Ba(OH)2+CO2 =BaCO3↓+H2O |
| B.bc段与cd段所消耗CO2的体积相同 |
| C.bc段反应的离子方程式是2AlO2-+3H2O+CO2 = 2Al(OH)3↓+CO32- |
| D.de段沉淀减少是由于BaCO3固体的消失 |
在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是( )
| A.Mg(OH)2的溶解度最小 | B.Ca(OH)2的溶解度最小 |
| C.AgCl的溶解度最小 | D.三种物质的Ksp都随着温度升高而增大 |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11mol·L-1 ×10-11mol·L-1 |
当固体AgCl放在较浓的KI溶液中振荡时,则部分AgCl转化为AgI,原因是
| A.AgI比AgCl稳定 | B.碘氧化性比氯弱 |
| C.I-的还原性比Cl-强 | D.溶解度AgI<AgCl |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
溴乙烷与NaOH溶液共热后,加入AgNO3溶液 |
未出现淡黄色沉淀 |
溴乙烷没有水解 |
| C |
向等浓度的KCl、KI混合液中滴加AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgCl)<Ksp(AgI) |
| D |
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静止 |
下层液体显紫红色 |
氧化性:Fe3+>I2 |
下列溶液中各离子的浓度关系正确的是
| A.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)="0.1" mol·L-1 |
| B.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) |
| C.25℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) |
| D.将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
已知 ①同温度下的溶解度;Zn(OH)2 > ZnS,MgCO3 > Mg(OH)2;②溶解或电离出S2-的能力:FeS > H2S > CuS,则下列离子方程式错误的是
| A.Mg2++ 2HCO3-+ 2Ca2+ + 4OH-→Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Zn2+ + S2-+ 2H2O→Zn(OH)2↓+ H2S↑ |
| C.Cu2+ + H2S→ CuS↓+ 2H+ |
| D.FeS + 2H+→ Fe2++ H2S↑ |
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是
Ca2++2OH-下列说法正确的是
| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
已知25 ℃时,CH3COONH4溶液呈中性。
Ⅰ.将0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合(混合溶液的体积变化忽略不计),测得混合溶液的pH=9。回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因________________________。
(2)混合后溶液中c(CH3COOH)=_________________mol·L-1 (填写精确值)。
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3②CH3COONH4③(NH4)2SO4④NH4Cl,pH由大到小的排列顺序为____________________(填序号)。
Ⅱ. Mg(OH)2沉淀可溶解于NH4Cl溶液。同学对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH-导致沉淀溶解;乙同学认为是NH与Mg(OH)2电离出的OH-反应生成弱电解质NH3·H2O,导致沉淀溶解。
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是( )
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(5)丙同学选择该试剂的理由是:_____________________。
(6)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,由此可知:________(填“甲”或“乙”)的解释更合理。Mg(OH)2沉淀与NH4Cl溶液反应的离子方程式为:____________________。
(7)现有Mg(OH)2和Al(OH)3沉淀的混合物,若除去Mg(OH)2得到纯净的Al(OH)3,可用______________(填写所用试剂的化学式,试剂从本题涉及的试剂中选取,下同);若除去Al(OH)3得到纯净的Mg(OH)2,可用_________________。
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
下列说法错误的是
| A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0 △S>0 |
| B.铅蓄电池放电时的负极和充电时的正极均发生氧化反应 |
| C.氯化镁溶液加热蒸干得不到纯净氯化镁固体 |
D.常温下,向饱和 溶液中加少量 溶液中加少量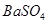 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)>Ksp(BaSO4) 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)>Ksp(BaSO4) |
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
| A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
| B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强 |
| C.向硝酸银溶液中加入同浓度的氯化钠和溴化钠溶液,先产生浅黄色沉淀,则Ksp(AgBr)>Ksp(AgCl) |
| D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大 |
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为(忽略溶液体积变化)
| A.1.8×10-7mol/L | B.1.8×10-8 mol/L |
| C.1.8×10-9mol/L | D.1.8×10-10mol/L |
试题篮
()