化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
①FeS的Ksp大于CuS的Ksp
②该反应平衡常数K=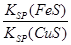
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变
④达到平衡时c(Fe2+)=c(Cu2+)
| A.②③ | B.①③④ | C.①② | D.②③④ |
(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
| CaS04 |
Mg2(OH) 2C03 |
CaC03 |
BaS04 |
BaC03 |
| 2.6x 1 0-2 |
2.5×10-4 |
7.8x 10-4 |
2.4x 10-4 |
1.7 x 1 0-3 |
①检测Fe3+是否除尽的方法是__________________________________________________________。
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因______________________________。
③除去Mg2+的离子方程式是____________________________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测__________________________(填离子符号)。
(2)第二次精制要除去微量的Iˉ、IO3ˉ、 、Ca2+、Mg2+,流程示意如下:
、Ca2+、Mg2+,流程示意如下:
①过程IV除去的离子是____________________________________。
②盐水b中含有SO42-。Na2S203将IO3ˉ还原为I2的离子方程式是 ______________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:_______________________.
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是______________________。
(2)已知: 20℃时溶解度/g
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程___________________。
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有_______________________。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因__________________。
(4)步骤Ⅲ中,加入Na2SO3的目的是___________________(结合离子方程式用文字表达)。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:

②下面检测钝化效果的方法合理的是____________________________。
a. 在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b. 在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c. 在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d. 在炉面上滴加浓HNO3,观察出现红棕色气体的时间
下列有关计算的分析正确的是
| A.某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol |
| B.室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c |
C.已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37 Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37 |
D.在25 ℃下,将2a mol·L-1的氨水与0.02 mol·L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3·H2O的电离常数  |
有效利用现有资源是解决能源问题的一种实际途径,发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)以CO和CO2分别与H2为原料,在一定条件下均可合成甲醇(CH3OH)。你认为用哪种合成设计路线更符合“绿色化学”理念:(用化学反应方程式表示)____________;
(2)下图表示在恒容容器中230℃催化剂条件下,0.5molCO2和1.5molH2反应得到甲醇蒸气,产率达80%时的能量变化示意图。

①写出该反应的热化学方程式:_____________________。
②能判断该反应达到化学平衡状态的依据是_____________________。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中气体密度不变
(3)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:负极______。

(4)“催化还原”反应制乙二醇(HOCH2-CH2OH)原理如下:
CH3OOC-COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究,下图表示乙二醇达平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强时P(丙)=___________。

(5)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸。H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示曲线①代表的粒子是___________;草酸氢钾溶液中存在如下平衡:H2O H++OH-,HC2O4-
H++OH-,HC2O4- H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)
H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)

目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大。
I.铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。铅蓄电池充放电的总反应方程式为:
PbO2+Pb+2H2SO4 2PbSO4+2H2O,
2PbSO4+2H2O,
请根据上述情况判断:
(1)电池的负极材料是 。
(2)充电时,铅蓄电池阳极的电极反应式为 。
Ⅱ.铅蓄电池使用量的急速增加引起铅污染日益严重,工业上从废铅蓄电池的铅膏回收铅的一种工艺流程如下:
请回答下列问题:
(3)为提高步骤①的化学反应速率,你认为可采取的措施是 (写一条即可)。
(4)写出步骤①中PbSO4转化为PbCO3反应的平衡常数表达式:K = 。
(5)步骤①中发生氧化还原反应的化学方程式为 。
(6)步骤③从母液可获得的副产品为 (写化学式)。
(7)已知:PbCO3在一定条件下可制得PbO,PbO通过进一步反应可制得Pb,写出一个由PbO生成Pb的化学方程式: 。
(18分)银是一种在工业、生活上有广泛用途的金属。
已知:①金属在水中存在如下溶解平衡过程:M  Mx+ + xe-,
Mx+ + xe-,
氢气在水溶液中也存在如下平衡过程:H2 2H+ + 2e-
2H+ + 2e-
②Ag2S 的Ksp=6.7×10-50; AgCl的Ksp=1.6×10-10
据此回答下列有关问题:
(1)银质餐具可杀菌消毒,原因是_________________(用适当的方程式和文字表述说明);金属银与氢硫酸可反应生成黑色固体和无色气体,写出该反应的化学方程式_______________
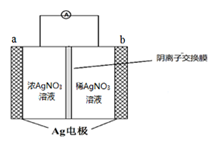
(2)金属银与硝酸银溶液组成电池示意图如右,a电极的反应为________________,NO3-从电池________侧溶液向电池_______侧溶液移动 (填“左”或“右”)。
(3)硝酸银见光或受热易分解为Ag、NO2、O2,反应中生成NO2、O2的 物质的量之比为___________,将混合气体通过水吸收后,剩余气体为________________
(4)已知:Ag+(aq) + 2NH3•H2O(aq)  [Ag(NH3)2]+ (aq) + 2H2O K=1.6×107,写出AgCl溶于氨水的离子方程式________________________;计算该反应的平衡常数K=___________。在氯化银溶于氨水后的溶液中滴加稀硝酸,会再产生白色氯化银沉淀,滴加硝酸至刚好沉淀完全,取上层清液测其pH,发现呈酸性,主要原因是_______________(用离子方程式表示)。
[Ag(NH3)2]+ (aq) + 2H2O K=1.6×107,写出AgCl溶于氨水的离子方程式________________________;计算该反应的平衡常数K=___________。在氯化银溶于氨水后的溶液中滴加稀硝酸,会再产生白色氯化银沉淀,滴加硝酸至刚好沉淀完全,取上层清液测其pH,发现呈酸性,主要原因是_______________(用离子方程式表示)。
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12。下列关于该温度下的叙述正确的是:
| A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小 |
| B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| C.若向0.0008 mol·L-1的K2CrO4溶液中加入等体积0.002 mol·L-1的AgNO3溶液,则CrO42-完全沉淀(提示:沉淀完全c(CrO42-)≤10-5 mol·L-1) |
| D.若将0.001 mol·L-1 AgNO3溶液滴入浓度均为0.001 mol·L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。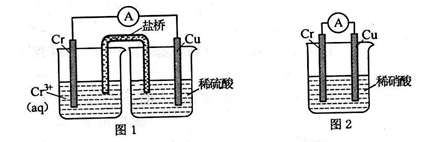
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。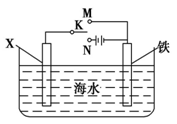
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
下列相关实验能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题。
(1)等物质的量浓度的下列四种溶液:①NH3·H2O ②(NH4)2SO3③KHSO3④K2SO3溶液中水的电离程度由大到小的排列顺序为________________(填序号)。
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________。将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________(填序号)。
(3)已知,H+ (aq) + OH-(aq) ="=" H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为____________。
(4)25℃时,NH3·H2O的电离常数为Kb=1.7×10-3。0.1mol·L-1NH4Cl溶液的pH=a,则c(NH4+)∶c(NH3·H2O)=_________(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣ H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
I.下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t 1 |
t 2 |
| 水的离子积 KW |
1×10-14 |
1×10-13 |
1×10-12 |
试回答以下问题:
(1)25℃下,某 Na2SO4溶液中 c(SO42-)=5×10-4 mol∙L-1,取该溶液 1mL 加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=____________。
(2)在 t 2℃下,将 a mol∙L-1CH3COOH 溶液与 b mol∙L-1NaOH 溶液等体积混合反应后,溶液恰好呈中性,则该温度下 CH3COOH 的电离常数 Ka=____________(用 a、b 表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
②2Ag+(aq)+2OH-(aq)  Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
(3)写出 Ag2O溶于氨水(用 NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;
计算 25℃下,该反应的平衡常数(用 c、d 表示)K =____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
| 离子 |
Mg2+ |
Cr3+ |
Cl- |
| 浓度(mol/L) |
0.5 |
0.01 |
a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的 a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节 pH 的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2∙6H2O)的操作是___________________。
下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且 3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后: c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12, |
则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
| |
CaSO4 |
CaCO3 |
MgCO3 |
Mg(OH)2 |
CuS |
BaSO4 |
H2S |
H2CO3[] |
| KSP或Ka |
9.1х10-6 |
2.8х10-9 |
6.8х10-6 |
1.8х10-11 |
6.3х10-36 |
1.1х10-10 |
Ka1=1.3х10-7 Ka2=7.1х10-15 |
Ka1=4.4х10-7 Ka2=4.7х10-11 |
则下列说法不正确的是
A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4
B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+===CuS↓+H+
C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理
D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl=CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是 。
(2)工业上为除去溶液中的_________。溶液的pH变化是 。
(3)若此溶液只含Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入 。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
试题篮
()