已知,常温下,KSP (AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17 mol2·L-2,下列叙述中,正确的是
| A.常温下,AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 |
| B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
| C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
| D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)
| 离子 |
Mg2+ |
Al3+ |
物质 |
Al(OH)3 |
| 开始沉淀时的pH |
8.93 |
3.56 |
开始溶解时的pH |
8.04 |
| 完全沉淀时的pH |
10.92 |
4.89 |
完全溶解时的pH |
12.04 |

25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类相同 |
| C.c(OH-)前者小于后者 |
| D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
下列对沉淀溶解平衡的描述正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度大于CD的溶解度
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
下列对沉淀溶解平衡的描述正确的是
| A.电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程 |
| B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
| C.沉淀溶解达到平衡时,溶液中溶质的各离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>K[Al(OH)3];则下列相关离子方程式正确的是
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合: HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质: 2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |
已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15,在AB2、AC均为饱和的混合液中,测得c(B-)=1.6×10-3 mol·L-1,则溶液中c(C2-)为 ( )
A.1.8×10-13 mol·L-1 B.7.3×10-13 mol·L-1
C.2.3 mol·L-1 D.3.7 mol·L-1
下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
下列对沉淀溶解平衡的描述正确的是
| A.反应开始时溶液中个离子浓度相等 |
| B.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
25℃时,水的电离达到平衡:H2O H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| D.将水加热,Kw增大,pH不变 |
已知t ℃时的Ksp (AgC1) =1.6×10-10,Ksp (AgBr )=7.8×10-13;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是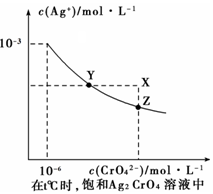
| A.t℃时,Ksp (Ag2CrO4 )=1×10-9 |
| B.t℃时,在饱和Ag2CrO4溶液中加入AgNO3可使溶液由Z点到X点 |
| C.t℃时,溶解度的大小顺序为AgC1 > Ag2CrO4>AgBr |
| D.t℃时,取一定量的KCl和KBr的混和溶液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,c(C1-)/c(Br-)= Ksp (AgC1)/ Ksp (AgBr) |
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
下列说法不正确的是
| A.化学反应是旧键断裂和新键形成的过程 |
| B.盖斯定律实质上是能量守恒定律的体现 |
| C.反应前后分子数不变遵循的是质量守恒定律 |
| D.溶解平衡、水解平衡和电离平衡均为动态平衡 |
某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2 mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是( )
| A.③>①>④>② | B.③>①>②>④ |
| C.①>④>③>② | D.①>③>④>② |
试题篮
()