仅根据题中图示得出的结论不合理的是
| |
A |
B |
C |
D |
| 图示 |
 |
 |
 |
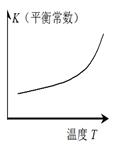 |
| 结论 |
HB为弱酸 |
HF为弱电解质 |
溶解度:AgI<AgCl |
正反应 △H>0 |
下列说法正确的是 ( )
| A.某物质的溶解性为难溶,则该物质不溶于水 |
| B.不溶于水的物质的溶解度为0 |
| C.绝对不溶解的物质是不存在的 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为淡黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系是( )
| A.AgCl=AgI=Ag2S | B.AgI> AgCl> Ag2S |
| C.AgCl>AgI>Ag2S | D.AgCl<AgI<Ag2S |
已知常温下,KSP(AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17mol2·L-2,下列叙述中, 正确的是( )
| A.常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 |
| B.向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 |
| C.将 0.001 mol·L-1的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 |
| D.向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
在饱和Mg(OH) 2溶液中,c(OH-)=1.0×10-4 mol·L-1。若往该溶液中加入NaOH溶液,使溶液的c(OH-)变为原来的10倍,则Mg(OH) 2的溶解度在理论上将( )
| A.变为原来的10-3倍 | B.变为 原来的10-2倍 |
| C.变为原来的103倍 | D.不发生变化 |
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Al3+和K+。取该溶液200mL,加入过量浓NaOH溶液,加热,得到448mL气体(标准状况下测定),同时产生红褐色沉淀;过滤,洗涤,灼烧,得到3.2g固体;向上述滤液中加足量BaCl2溶液,得到9.32g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.SO42ˉ、NH4+一定存在,Clˉ可能不存在 |
| C.Clˉ一定存在,且c(Clˉ)≥0.3mol/L |
| D.CO32ˉ、Al3+一定不存在,K+可能存在 |
常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17。下列有关说法中,错误的是( )
| A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减弱 |
| B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
| C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比 |
| D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出 |
硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等。某温度时HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
| A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小 |
| B.图中a点对应的是饱和溶液 |
| C.向c点的溶液中加入0.1mol/LHg(NO3)2,则c(S2-)减小 |
| D.升高温度可以实现c点到b点的转化 |
下列叙述或表示正确的是( )
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)="x" mol·L﹣1,c(B﹣)="y" mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |
向盛有0.1mol/LAgNO3溶液的试管中滴加 0.05mol/LNa2S溶液至沉淀完全,再向上层清液中滴加足量 NaCl,产生的现象及发生的反应是
| A.黑色沉淀完全转化为白色沉淀 | B.既有Ag2S也有 AgCl |
| C.不能由黑色沉淀转变为白色沉淀 | D.只有 AgCl白色沉淀 |
用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. | 根据曲线数据计算可知 的数量级为 |
B. | 曲线上各点的溶液满足关系式 |
| C. | 相同实验条件下,若改为 , 反应终点c移到a |
D. | 相同实验条件下,若改为 , 反应终点c向b方向移动 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgBr >AgI>AgCl |
| C.AgBr >AgCl>AgI | D.AgCl> AgBr>AgI |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
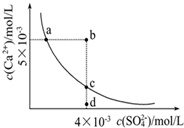
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
饱和石灰水中存在溶解平衡:Ca(OH)2(s)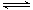 Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
| A.溶液的pH不变 | B.溶液中Ca2+的浓度减小 |
| C.溶液中OH-的数目减小 | D.容器中固体的质量增加 |
试题篮
()