某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是
| A.加入Na2SO4可使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.b点有BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
| A.图中a点对应的是AgBr的不饱和溶液 |
| B.在t℃时, Ksp(AgBr) =4.9×10-13 |
C.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈816 AgBr(s)+Cl-(aq)的平衡常数K≈816 |
| D.在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到c点 |
下列说法正确的是( )
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大 |
| D.室温下,CH3COOH的KW=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 |
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
| A.只有AgBr沉淀生成 |
| B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀少于AgBr沉淀 |
| D.AgCl沉淀多于AgBr沉淀 |
下列事实与结论(或推论)均正确的是( )
| A.将浓氨水加到盛有AgCl固体的试管中,AgCl固体完全溶解,则所得溶液中c(Ag+)·c(Cl-)>Ksp(AgCl) |
| B.物质的量之比为12的Na2O2和NaHCO3的固体混合物,在密闭容器中充分加热反应后,残留的固体是Na2CO3 |
| C.向FeBr2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色;那么向FeI2溶液中通入少量的氯气,也会出现同样的现象 |
| D.将某混合气体通入品红溶液中,溶液不褪色,该气体中无Cl2 |
下列说法不正确的是:
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时, Ksp不变 |
| D.两种难溶电解质作比较时, Ksp小的,溶解度一定小 |
用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. | 根据曲线数据计算可知 的数量级为 |
B. | 曲线上各点的溶液满足关系式 |
| C. | 相同实验条件下,若改为 , 反应终点c移到a |
D. | 相同实验条件下,若改为 , 反应终点c向b方向移动 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgBr >AgI>AgCl |
| C.AgBr >AgCl>AgI | D.AgCl> AgBr>AgI |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
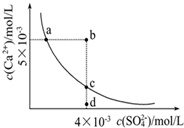
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
饱和石灰水中存在溶解平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
| A.溶液的pH不变 | B.溶液中Ca2+的浓度减小 |
| C.溶液中OH-的数目减小 | D.容器中固体的质量增加 |
下列实验对应的现象及结论均正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A |
SO2通入BaCl2溶液,然后滴入稀硝酸 |
白色沉淀,白色沉淀不溶于稀硝酸 |
所得沉淀为BaSO3,后转化为BaSO4 |
| B |
浓硫酸滴入蔗糖中,并搅拌 |
得黑色蓬松的固体并有刺激性气味气体 |
该过程中浓硫酸仅体现吸水性和脱水性 |
| C |
向FeCl2溶液中加入足量Na2O2粉末 |
出现红褐色沉淀和无色气体 |
FeCl2溶液部分变质 |
| D |
向足量含淀粉的FeI2溶液中滴加2滴氯水 |
溶液变蓝 |
还原性:I->Fe2+ |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
已知:在一定温度下,微溶电解质Ca(OH)2在饱和溶液中建立沉淀—溶解平衡:Ca(OH)2(s)  Ca2+(aq)+2OH-(aq),溶度积常数Ksp=c(Ca2+)c(OH-)2.下列有关说法不正确的是
Ca2+(aq)+2OH-(aq),溶度积常数Ksp=c(Ca2+)c(OH-)2.下列有关说法不正确的是
| A.饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 |
| B.升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 |
| C.饱和石灰水中加入生石灰,若保持温度不变,则pH不变 |
| D.向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是
| 选项 |
规律 |
结论 |
| A |
较强酸可以制取较弱酸 |
用亚硫酸溶液无法制取硫酸溶液 |
| B |
升高温度,反应速率越快 |
常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
| C |
金属越活泼,其阳离子氧化性越弱 |
Fe3+的氧化性弱于Cu2+ |
| D |
Ksp小的沉淀易向Ksp更小的沉淀转化 |
CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
| |
AgCl |
AgI |
Ag2S |
| Ksp |
1.8×10-10 |
8.51×10-16 |
6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
试题篮
()