已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX与pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。某温度下,卤化银(AgX,X=Cl,Br,I)的三条沉淀溶解平衡曲线如图,B线表示AgBr。下列说法错误的是
| A.A线是AgCl,C线是AgI |
| B.三条线一定是平行的 |
| C.d点是在水中加入足量的AgBr形成的饱和溶液 |
| D.e点表示由过量的KI与AgNO3反应产生AgI沉淀 |
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
| A.升高温度 | B.加水稀释 |
| C.增大Fe2+的浓度 | D.常温下加压 |
已知:25℃时, Ksp[Mg(OH)2] = 5.61×10-12、Ksp [MgF2]=7.42×101。下列说法正确的是( )
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成MgF2 |
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10 mol·L-3。现向1L 0.2 mol·L-1 HF溶液中加入1L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.KSP(CaF2)随温度和浓度的变化而变化 |
| C.该体系中有CaF2沉淀产生 | D.以上说法均不正确 |
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是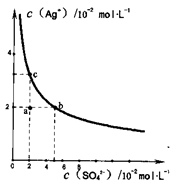
| A.Ag2SO4的溶度积常数(Ksp)为1×10-3 |
| B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合有Ag2SO4沉淀生成 |
| C.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到c点 |
| D.a点表示Ag2SO4的不饱和溶液,加入Na2SO4固体可以使溶液由a点变到b点 |
实验:①0.1 mol•L-1AgNO3溶液和0.1 mol•L-1NaCl溶液等体积混合得到浊液,过滤。②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是
| A.实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- |
| B.由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
| C.实验的③溶液中含有[Ag(NH3)2]+微粒 |
| D.实验②证明了该温度下Ag2S比Ag2SO4更难溶解 |
向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成,经查资料得知:
Ag++2NH3•H2O Ag(NH3)2++2H2O下列分析不正确的是
Ag(NH3)2++2H2O下列分析不正确的是
A.浊液中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.实验表明实验室可用氨水洗涤银镜反应后的试管 |
| C.实验可以证明NH3结合Ag+能力比Cl--强 |
| D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl |
分别依据下列实验事实,得出的结论正确的是
| |
实验事实 |
结论 |
| A |
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
随溶液pH减小,“84”消毒液的氧化能力增强 |
| B |
苯酚和水的浊液中,加碳酸钠溶液,溶液变澄清 |
苯酚的酸性比碳酸强 |
| C |
铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 |
硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |
向1mL 0.1mol/L的硝酸银溶液中加入1mL0.1mol/LNaCl溶液,出现白色沉淀,再加入几滴0.1mol/L NaBr溶液,有淡黄色沉淀生成 |
氯化银的溶解度小于溴化银 |
在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如右
图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是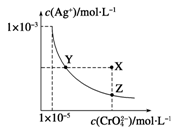
| A.t ℃时,Ag2CrO4的Ksp为1×10-8 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t ℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| D.t ℃时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0. 01 mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀 |
下列解释实验事实的方程式中,不准确的是
A.在CH3COONa溶液中滴入无色酚酞,溶液变红:CH3COO-+H2O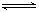 CH3COOH+OH- CH3COOH+OH- |
| B.在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐: 3Mg(OH)2+2Fe3+===2Fe(OH)3+3Mg2+ |
| C.在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3=Na++H++SO32- |
| D.在稀H2SO4酸化的KMnO4溶液中滴入双氧水,溶液褪色: |
2MnO4-+5H2O2+6H+===2Mn2++5O2↑+8H2O
下列叙述正确的是
| A.中和pH和体积均相同的盐酸和醋酸溶液,消耗相同浓度的NaOH的体积较多的是醋酸 |
| B.FeCl3溶液和Fe2(SO4)3溶液蒸干、灼烧都得到Fe2O3 |
| C.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
| D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
下表是三种难溶金属硫化物的溶度积常数(25℃):
| 化学式 |
FeS |
CuS |
MnS |
| 溶度积 |
6.3×10-18 |
1.3×10-36 |
2.5×10-13 |
下列有关说法中正确的是( )
A.25℃时,CuS的溶解度大于MnS的溶解度
B.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol•L-1
C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
根据Al(OH)3的Ksp = 1.3×10-33、 Mg(OH) 2的Ksp =5.6×10-12 ,等物质的量浓度AlCl3、MgCl2
混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:
下列有关说法正确的是
| A.Al(OH) 3和Mg(OH)2在水溶液中的电离过程完全相同 |
| B.若改变溶液的pH,在pH<4.7时,n(Mg2+)几乎不变化 |
| C.当pH>11.1时,溶液中只有NaCl和NaAlO2(Na[Al(OH)4]) |
| D.物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,氨水的pH与沉淀量关系与上图相似 |
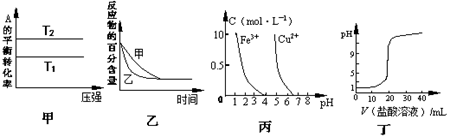
下列图示与对应的叙述相符的是
A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0 2C(g)的△H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
试题篮
()