25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
向紫色Cr2(SO4)3溶液中加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色)+ 3OH- Cr(OH)3(灰蓝色)
Cr(OH)3(灰蓝色) CrO2-(绿色)+ H+ + H2O。将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为
CrO2-(绿色)+ H+ + H2O。将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为
| 选项 |
A |
B |
C |
D |
| a试管 |
紫色 |
蓝灰色 |
绿色 |
蓝灰色 |
| b试管 |
绿色 |
绿色 |
紫色 |
紫色 |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),pc(CO32-)=-lgc(CO32-)。下列说法正确的是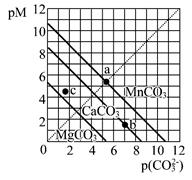
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a点可表示MnCO3的饱和溶液,且c(Mn2+)> c(CO32-) |
| C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-) |
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- |
| C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol·L-1的盐酸时,下列说法正确的是
| A.AgCl沉淀溶解平衡正向移动 | B.AgCl溶解度增大 |
| C.溶液中c(Ag+)增大 | D.溶液中c(Cl-)增大 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI>Ag2CrO4 | B.AgCl>Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp (25℃)如下:
| |
AgCl |
AgI |
Ag2S |
| Ksp(单位省略) |
1.8×10-10 |
1.5×10-16 |
6.3×10-50 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀容易转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
关于下图所示实验的说法不正确的是
| A.乙中产生的气泡是C02 |
| B.丙中液体可产生丁达尔现象 |
| C.若忽略溶液体积的变化,烧杯中c(Cl-)不发生变化 |
| D.若将CaC03换成CaS04也可得到相同的实验现象 |
Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是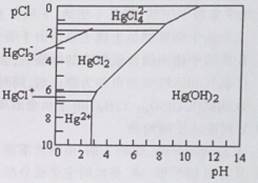
| A.可用如下方法除去污水中的Hg2+: FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
| B.当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 |
| C.HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCI++Cl- |
| D.当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是
| A.加入Na2SO4可以使溶液由a点变为b点 |
| B.通过蒸发可以使溶液由d点变为c点 |
| C.b点有BaSO4沉淀生成 |
| D.a点对应的KSP大于c点对应的Ksp |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
Ag2CO3白色悬浊液中加入Na2S溶液 |
沉淀变为黑色 |
Ksp(Ag2S)>Ksp(Ag2CO3) |
| B |
向苯酚钠溶液中通入CO2 |
溶液变浑浊 |
碳酸的酸性比苯酚强 |
| C |
向蛋白质溶液中加入甲醛和(NH4)2SO4饱和溶液 |
均有白色沉淀 |
蛋白质均发生了变性 |
| D |
向溶液X中加入Na2O2粉末 |
出现红褐色沉淀和无色气体 |
X中一定含有Fe3+ |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是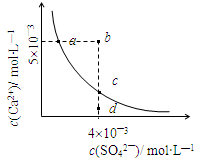
| A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42—)对应于曲线上任意一点 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42—)等于3×10-3 mol·L—1 |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
下列叙述正确的是
| A.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
| C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
| D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
相关物质的溶度积常数见下表(25℃):
| 物质 |
Mg(OH)2 |
CH3COOAg |
AgCl |
Ag2CrO4 |
| Ksp(单位略) |
1.1×10-11 |
2.3×10-3 |
1.8×10-10 |
1.9×10-12 |
下列有关说法中不正确的是
A.浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 mol·L-1的AgN03溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4混合溶液中。先产生Ag2CrO4沉淀
C.0.ll mol·L-1的MgCL2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
试题篮
()