25℃时,水的电离达到平衡:H2O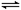 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
| A.向水中加入稀醋酸,平衡逆移,c(H+)降低 |
| B.将水加热,KW增大,pH不变 |
| C.向水中加入少量固体硫酸氢钾,c(H+)增大,KW不变 |
| D.pH=10的NaOH溶液与pH=10的NaClO溶液中,水电离c(H+)之比等于106 |
定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-) = 10-5 mol·L-1,AgNO3与CrO42- 生成砖红色的Ag2CrO4沉淀。已知Ksp(AgCl) = 1.77×10-10,Ksp(AgI) = 8.51×10-17,Ksp(Ag2CrO4) = 1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是
| A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变 |
| B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1 |
| C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl) |
| D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂 |
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液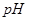 的变化如下图所示。下列判断正确的是( )
的变化如下图所示。下列判断正确的是( ) 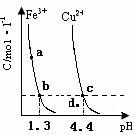
A.加适量浓NH3·H2O可使溶液由 点变到 点变到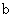 点 点 |
B.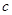  两点代表的溶液中 两点代表的溶液中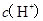 与 与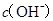 乘积不相等 乘积不相等 |
C.Cu(OH)2在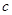 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的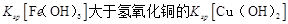 |
下列各组中的比值等于2:1的是( )
| A.pH为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 |
| B.K2S溶液中c(K+)与c(S2-)之比 |
| C.相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比 |
| D.10mL0.5mol/L的盐酸与5mL0.5mol/L的盐酸溶液中的c(H+)之比 |
今有室温下四种溶液,有关叙述不正确的是
| |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11∶9
下列说法正确的是
| A.难溶电解质的溶度积越小,溶解度越大 | B.可以通过沉淀反应使杂质离子浓度为0 |
| C.难溶电解质的溶解平衡是一种静态平衡 | D.一定浓度的NH4Cl溶液可以溶解Mg(OH)2 |
某温度下,
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液 ,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是
A. |
B.加适量 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C.  两点代表的溶液中 两点代表的溶液中 与 与 乘积相等 乘积相等 |
D. 、 、 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.该体系中有CaF2沉淀产生 |
C.该体系中KSP(CaF2)= |
D.KSP(CaF2)随温度和浓度的变化而变化 |
现有①0.1mol/L醋酸溶液;②0.1mol/L盐酸;③pH =" 1" 的醋酸溶液,分别加水稀释,使体积变为原来的10倍,对于稀释前后溶液的有关说法错误的是( )
| A.稀释前,溶液 pH:①>② = ③ |
| B.稀释前,溶液中溶质的物质的量浓度:③>① =② |
| C.稀释后,溶液 pH:①>② = ③ |
| D.稀释后,溶液中溶质的物质的量浓度:③>① =② |
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
已知:(1) CuS04十 Na2C03
主要 : Cu2+ + C032- + H20 ="=" Cu(OH)2 ↓十 CO2 ↑
次要 : Cu2+ + C032- ="=" CuC03↓
(2) CuS04 + Na2S
主要 : Cu2+ + S2- ="=" CuS ↓
次要 : Cu2+ + S2- + 2H20 ="=" Cu(OH)2↓+ H2S ↑
下列几种物质的溶解度大小的比较中,正确的是
| A.CuS <Cu(OH)2<CuC03 | B.CuS >Cu(OH)2>CuC03 |
| C.Cu(OH)2>CuC03>CuS | D.Cu(OH)2<CuC03<CuS |
下列物质与水作用形成的溶液能与反应生成
的是
| A. | 二氧化氮 | B. | 钠 | C. | 硫酸镁 | D. | 二氧化硅 |
已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是 
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
C.25°C时,Mg(OH)2固体在20ml0.01 mol·L-1氨水中的Ksp比在20mL0.01 mol·L-1NH4Cl溶液中的Ksp小 |
D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
下列说法正确的是
| A.物质的溶解性为难溶,则该物质不溶于水 |
| B.物质的溶解度都随温度的升高而增大 |
| C.绝对不溶于水的物质是不存在的 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
试题篮
()