向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| D.该过程破坏了ZnS的溶解平衡 |
下列说法不正确的是
| A.同温下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大 |
| B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl多 |
| C.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
| D.除去溶液中的Mg2+,用OH-比CO效果好,说明Mg(OH)2的溶解度比MgCO3的小 |
下列化学实验事实及解释都正确的是
| A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力 |
B.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: |
| C.升高温度会加快化学反应速率,其原因是增加了单位体积内活化分子的百分数 |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。 |
下列说法正确的是
| A.常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp (BaCO3)<Ksp (BaSO4) |
| B.常温下,向纯水中加入钠或氢氧化钠都能使水的电离平衡逆向移动,水的离子积不变 |
| C.常温下,反应4Fe(OH)2(s)+ O2(g) +2H2O(l) =4Fe(OH)3(s)的△H<0、△S<0 |
| D.铅蓄电池在工作过程中,负极质量减少,阳极质量增加 |
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| D.该过程破坏了ZnS的溶解平衡 |
下列说法正确的是( )
| A.KW随溶液浓度的改变而改变 |
| B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 |
| D.一般情况下,一元弱酸HA的Ka越大,表明该酸的酸性越弱 |
90 ℃时水的离子积KW=3.8×10-13,该温度时纯水的pH是( )
| A.等于7 | B.小于7 | C.大于7 | D.无法确定 |
下表是3种物质的溶解度(20℃),下列说法中正确的是
| A.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有 c(Mg2+)=c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6 |
| B.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 |
| C.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| D.用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为 |
Mg2++2 HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
难溶物质在水中达到溶解平衡的溶度积常数与水的电离平衡常数相似。则关于BaSO4溶解平衡: 的下列说法正确的是( )
的下列说法正确的是( )
| A.溶液的温度升高,BaSO4的溶度积常数不变 |
| B.在Na2SO4溶液中,BaSO4的溶解度不变 |
| C.在BaCl2溶液中,BaSO4的溶度积常数变小 |
| D.精制NaCl时,在溶液中加入稍过量的BaCl2溶液是为了更好地除去SO42-等离子 |
已知25OC时,电离常数Ka(HF)=3.6 10-4 mol
10-4 mol L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3
L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3 L-3。现向1L0.2 mol
L-3。现向1L0.2 mol L-1HF溶液中加入1L0.2 mol
L-1HF溶液中加入1L0.2 mol L-1CaCl2溶液,
L-1CaCl2溶液,
则下列说法中,正确的是
A.25oC时,0.1 mol L-1HF溶液中pH=1 L-1HF溶液中pH=1 |
B.Ksp(CaF2)随温度和浓度的变化而变化 |
C.该体系中Ksp(CaF2)= |
D.该体系中有CaF2沉淀产生 |
已知,常温下,KSP(AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17
mol2·L-2,下列叙述中,正确的是
| A.常温下,AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 |
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl- |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16.下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于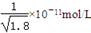 |
工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质 FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是:
| A.在水中的溶解能力大于CuS、CdS、PbS |
| B.在水中的溶解能力小于CuS、CdS、PbS |
| C.在水中的溶解能力与CuS、CdS、PbS相同 |
| D.二者均具有较强的吸附性 |
下列各实验中,先产生沉淀,然后沉淀又溶解的是 ( )
①向饱和碳酸钠溶液中通入CO2至过量
②向氯化铝溶液中逐滴加入氢氧化钠溶液至过量
③向AgNO3溶液中逐滴加入氨水至过量
④向硅酸钠溶液中逐滴加入盐酸至过量
| A.①② | B.①③ | C.①④ | D.②③ |
试题篮
()