已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+) c(OH-)。
I. H2A在水中存在以下平衡:H2A  H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为 。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是______________。
| A.c(Na+ )>c(K+ ) | B.c(H +)•c(OH )=1×10-14 |
| C.c(Na+ )=c(K+ ) | D.c(Na+ )+c(K+ )=c(HA- )+c(A2-) |
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O72-。为使废水能达标排放,作如下处理:

(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为: 。
(4)欲使25 L该废水中Cr2O72- 转化为Cr3+,理论上需要加入_________g FeSO4•7H2O。
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L ,则残留的 Cr3+的浓度为_________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
III.已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(以含w的代数式表示)
如图:横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。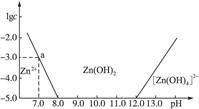
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为____________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是____________。
(4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式: ▲ 。
(2)白色固体转化成黑色固体的原因是: ▲ 。
已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)=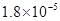 ,Ka(HSCN)=0.1,
,Ka(HSCN)=0.1,
难溶电解质的溶度积常数:Kap(CaF2)=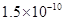
②25℃时,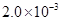 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: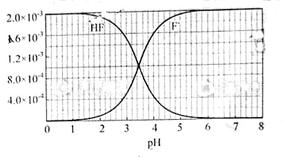
请根据以下信息回答下旬问题: 图2
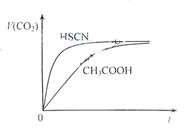
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka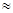 ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
(3)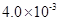 mol·L-1HF溶液与
mol·L-1HF溶液与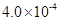 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), 通过列式计算说明是否有沉淀产生。
通过列式计算说明是否有沉淀产生。
(是,否)有沉淀产生
列式计算(过程):
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料.
已知:H2(g)+ O2(g)═H2O(g)△H1=﹣241.8kJ•mol﹣1
O2(g)═H2O(g)△H1=﹣241.8kJ•mol﹣1
C(s)+ O2(g)═CO(g)△H2=﹣110.5kJ•mol﹣1
O2(g)═CO(g)△H2=﹣110.5kJ•mol﹣1
则焦炭与水蒸气反应生成CO的热化学方程式为: .
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难.如果在实验室,你处理金属钠着火的方法是 .
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染.处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 .
(4)电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3﹣+4H+═5O2↑+2N2↑+2H2O,则阴极反应式为 .
(5)欲降低废水中重金属元素铬的毒性,可将Cr2O72﹣转化为Cr(OH)3沉淀除去,
已知在常温下:Ksp[Fe(OH)2]=1×10﹣15、Ksp[Fe(OH)3]=1×10﹣38、Ksp[Cr(OH)3]=1×10﹣23,当离子浓度在1×10﹣5mol/L以下时认为该离子已经完全沉淀,请回答:
①相同温度下Fe(OH)3的溶解度 Cr(OH)3的溶解度(填“>”、“<”或“=”)
②浓度为0.1mol/L的Fe2+与10.0mol/L Cr3+同时生成沉淀的pH范围是 .

硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
| A.氢氧化钠 | B.氧化铝 | C.氨水 |
D.水 |
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)H中溶质的化学式: ;
(5)计算溶液F中c(Mg2+)= ( 25℃时,氢氧化镁的Ksp=5.6×10-12)
在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:

(1)图中C点表示当加入 mol NaOH时,Al3+已完全转化为 (填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为 。
水是最常用的溶剂,许多化学反应都需要在水溶液中进行。请仔细分析并回答下列各题。
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图: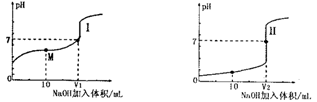
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为________,符合其滴定曲线的是_______(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是_________溶液(填化学式);
③图中v1和v2大小的比较:v1_______v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是______________。
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25 ℃ ):
| 操作步骤 |
现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 |
出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 |
溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 |
现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 |
出现黄色沉淀 |
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
① 请结合化学用语和必要的文字解释步骤2 现象出现的原因:____________________。
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为______________(任写一点即可)。
③ 写出步骤4 中沉淀转化反应平衡常数的表达式:K=__________。
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、CO32-、H2O、 、 。(填写微粒符号)
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液①NH4NO3、②NaCl、③NaClO、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为 。(填写溶液的序号)
(3)常温时,AlCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl、② (NH4)2SO4、 ③NH3·H2O ④ (NH4)2CO3、⑤ NH4HSO4。溶液中c(NH4+)从大到小的顺序为: 。(填写溶液的序号)
某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示: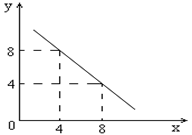
(1)该温度下水的离子积为 (填具体数值);该温度 常温(填“高于”、“低于”或“等于”)。
(2)该温度下0.01 mol/L NaOH溶液的pH为 。
(3)除了用pH外,科学家还建议用酸度(AG)来表示溶液的酸碱性: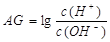 。则该温度下,0.01mol/L盐酸的酸度AG= 。
。则该温度下,0.01mol/L盐酸的酸度AG= 。
已知常温下,氨水中NH3·H2O的电离平衡常数:K=1.6×10-5;若NH3·H2O的起始浓度为1mol·L-;则平衡时c(OH-)=
设反应①Fe(S)+CO2(g)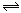 FeO(S)+CO(g)的平衡常数为
FeO(S)+CO(g)的平衡常数为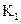 。反应②Fe(S)+H2O(g)
。反应②Fe(S)+H2O(g)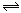 FeO(S)+H2(g)的平衡常数为
FeO(S)+H2(g)的平衡常数为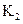 ,在不同温度下,
,在不同温度下,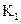 、
、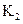 的值如下:
的值如下:
| 温度 |
 |
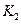 |
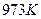 |
1.47 |
2.38 |
1173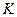 |
2.15 |
1.67 |
(1)从上表可以推断:反应①是_______________ (填“吸”、“放”)热反应。
(2)现有反应③H2(g)+CO2(g)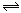 H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K
H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K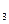 =____________。
=____________。
(3)根据反应①与②,可推导出K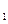 、K
、K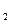 与K
与K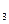 之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。
之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。
| A.缩小反应容器容积 | B.扩大反应容器容积 | C.降低温度 |
| D.升高温度 E.使用合适的催化剂 F.设法减少CO的量 |
(4)图l、2表示该反应③在时刻t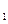 达到平衡、在时刻t
达到平衡、在时刻t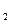 分别因改变某个条件而发生变化的情况:
分别因改变某个条件而发生变化的情况: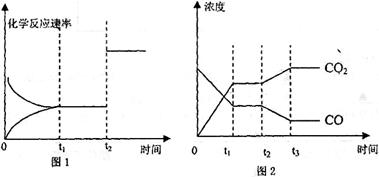
①图l中时刻t 发生改变的条件是_____________________________
发生改变的条件是_____________________________
②图2中时刻t 发生改变的条件是________________
发生改变的条件是________________
(1)Mg(OH)2在下列四种情况下,其溶解度大小关系为_______________。
A.在纯水中 B.在0.1 mol ·L-1的MgCl2溶液中 C.在0.1 mol ·L-1的CH3COOH溶液中
(2)向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
(2)在25 ℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:
(3)若某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-)=_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3 mol·L-1,则c(OH-)=_______________。
试题篮
()