请根据所学化学知识回答下列问题:
(1)氯化铁溶液蒸干并灼烧后得到的固体物质的化学式是________。
(2)在浓度均为0.1 mol/L的①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4四种溶液中,NH4+浓度由大到小的顺序为________(用代号表示)。
(3)25时,某浓度的CH3COONa溶液呈碱性的原因是________(用离子方程式表示),溶液中所有离子的浓度由大到小的顺序是________。
(4)某温度下,蒸馏水的pH = 6,氢氧化物R(OH)2的Ksp = 1×10-13,则R2+沉淀完全时,溶液的pH为_______。
(共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 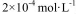 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)己知: 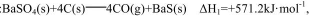

则反应 
(12分)海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一 。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 。
(6)电解熔融的MgCl2,阳极的电极反应式为: 。
(1)已知95℃时水的离子积Kw=1×10-12,此温度时向纯水中加入NaOH,c(OH-)=1×10-1mol·L-1,此时pH=________。
(2)已知KSP (Ag2CrO4)=1.12×10-12,将等体积的4×10-3mo1·L-1的AgNO3和4×10-3mo1·L–1K2CrO4混合,________产生Ag2CrO4沉淀(填“能”或“不能”)。
(1)请写出下列溶液的离子反应方程式:(13分)
①硫酸氢钠在溶液中的电离:
②氯化铵溶液除铁锈的原因:
③氯化铁溶液与偏铝酸钾溶液混合:
④碳酸钙的溶解平衡:
(2)在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,
以 (填“促进”、“抑制”)其水解。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产是 。把Na2SO3溶液蒸干,灼烧,最后得到的主要固体产是 。
(12分)如果类似于水的离子积Kw,溶液中c(Ag+)和c(Cl-)的乘积是一个常数:c(Ag+)·c(Cl-)=1.0×10-10,当溶液中c(Ag+)·c(Cl-)大于1.0×10-10时,才可能产生AgCl沉淀。现向50mL 0.018mol·L-1AgNO3溶液中加入50mL 0.02mol·L-1的盐酸(忽略溶液体积变化),生成了沉淀。求:
(1)沉淀生成后溶液中c(Ag+)= 。
(2)沉淀生成后溶液的pH= 。
(3)如果向沉淀生成后的溶液中再加入50mL 0.001mol·L-1的盐酸,观察到的现象是: ;
原因是(计算说明): 。
20.已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp_______(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是___________ (用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于 (已知Ksp[Cu(OH)2]=2.0×10-20)。
以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下:
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?请用必要的文字和离子方程式解释:_______________________________________________________。
(4)流程图中“□”内的操作是___________________、______________________、 。
(12分)氧化锌是重要的基础化工原料,从含锌废水(含Zn2+及少量的Mn2+、Fe2+及Pb2+等)为原料制取ZnO的实验流程如下:
已知几种难溶氢氧化物沉淀的PH范围
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Pb(OH)2 |
| pH |
2.2~3.2 |
5.8~7.9 |
5.5~13.5 |
7.0~13.0 |
(1)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为 ;滤渣I的主要成分除MnO2外,另一种
是 (写化学式)。
(2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有 (写化学式);滤渣II中含有二氧化锰,其可能原因是 。
(3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为 ;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是 。
(本题共12分)磷是重要的非金属元素。
28.有关白磷(P4)的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.25℃时,HF的Ki =" 3.6×10" – 4 ;
H3PO4的Ki1=" 7.5×10" -3,Ki2=" 6.2×10" -8,Ki3=" 2.2×10" -13。
则以下表述错误的是 (选填编号)。
a.0.1mol/L的H3PO4溶液,c(H+)>0.1mol/L
b.NaF和H3PO4反应生成NaH2PO4
c.0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4
31.Ag3PO4是难溶于水的黄色固体,试用平衡移动的原理解释其溶于稀硝酸的原因 。
电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是__________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是_____(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____。
③V1和V2的关系:V1_____V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 |
现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 |
溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 |
现象a,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式__________________。
②步骤3中现象a是_____________________。
③用化学平衡原理解释步骤4的实验现象______________________。
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp_______(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是___________ (用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于5 (已知Ksp[Cu(OH)2]=2.0×10-20)。
工业上为了处理有Cr2O72—的酸性废水,采用下面的处理方法:往工业废水里加入适量的NaCl,以Fe为电极进行电解,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中Cr3+的浓度若低于10—5mol/L可符合排放标准。回答下列问题:
(1)电解时阳极上发生的电极反应式: ;
(2)写出Cr2O72—变为Cr3+的离子方程式 ;
(3)工业废水由酸性变为碱性的原因是 ;
(4)已知室温下Cr(OH)3的KSP=1×10—32,则该温度下符合排放标准的溶液的最低pH为 。
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,所需溶液的pH分别为6.4、6.4、3.7。现由含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其配制成水溶液,然后按图示步骤进行提纯:
请回答下列问题:
(1)本实验最适合的氧化剂是( )(填下面的序号)
| A.K2Cr2O7 | B.NaClO | C.H2O2 | D.KMnO4 |
(2)物质Y是 ;(用化学式表示)
(3)本实验用碱沉淀法能否达到目的? ;原因是 ;
(4)除去Fe3+的原理是 ;
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+ 2OH-(aq),常温下其Ksp=2×10-20则:
Cu2+(aq)+ 2OH-(aq),常温下其Ksp=2×10-20则:
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于 。
(2)除去CuCl2溶液中少量的Fe2+,可以按照下面的流程进行:
已知Fe2+、Cu2+和Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如下:
| 金属 离子 |
pH |
|
| 开始沉淀 |
完全沉淀 |
|
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.4 |
6.4 |
| Fe3+ |
2.7 |
3.7 |
①下列物质中适合作为试剂X的是( )
A.H2O2 B.KMnO4 C.HNO3 D.Cl2
②加入的Y及调节的pH范围是( )
A.CuCO3 3.7~4.3 B.CuO 3.7~6.4
C.NaOH 3.7~4.2 D.NH3·H2O 3.7~4.0
检验Z沉淀完全的方法是:取1~2mL滤液于小试管中,加入1~2滴 溶液,现象 ,则沉淀完全。
试题篮
()