酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
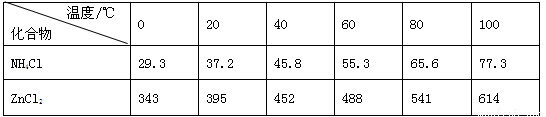
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过 __ 分离回收;滤渣的主要成分是MnO2、_ __ __和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_ ____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为 _时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
(14分)铬(Cr)是周期表中VIB族元素,化合价可以是 0 ~+6 的整数价态。回答下列问题:
(1)某铬化合物的化学式为 Na3CrO8,其阴离子结构可表示为 ,则Cr的化合价为 。
,则Cr的化合价为 。
(2)在如图装置中,观察到Cu电极上产生大量的无色气泡,Cr电极周围出现天蓝色(Cr2+) ,而后又变成绿色 (Cr3+)。该电池总反应的过程表示为: ,2Cr2++2H+= 2Cr3++ H2。左侧烧杯溶液中c(Cl-) (填“增大”,“减小”或“不变”)。
(3)已知Ksp(BaCrO4)=1.2×10-10, Ksp(PbCrO4)= 2.8×10-13, Ksp(Ag2CrO4)= 2.0×10-12。某溶液中含有Ba2+、Pb2+、Ag+,浓度均为0.01 mol/L ,向该溶液中逐滴入 0.01 mol/L Na2CrO4溶液时,三种阳离子产生沉淀的先后顺序为 。
(4)在溶液中存在如下平衡:
则反应 的平衡常数K= 。
的平衡常数K= 。
(5)CrO2-4呈四面体构型,结构为 。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为
。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为 。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
(6)CrO3是H2CrO4的酸酐,受热易分解。把一定量的 CrO3加热至790K时,残留固体的质量为原固体质量 76%。写出 CrO3受热分解化学方程式: 。
水是重要的自然资源,与人类的发展密切相关。
(1)25℃时,水能按下列方式电离:
H2O+H2O H3O++OH- K1=1.0×10-14
H3O++OH- K1=1.0×10-14
OH-+H2O H3O++O2- K2=1.0×10-36
H3O++O2- K2=1.0×10-36
水中c(O2-) = mol·L-1(填数值)。
(2)水广泛应用于化学反应。将干燥的碘粉与铝粉混合未见反应,滴加一滴水后升起紫色的碘蒸气,最后得到白色固体。有关该实验的解释合理的是 。
| A.加水使碘和铝粉形成溶液 | B.水作氧化剂 |
| C.碘粉与铝粉反应是放热反应 | D.水作催化剂 |
(3)铁酸铜(CuFe2O4)是很有前景的热化学循环分解水制氢的材料。
ⅰ.某课外小组制备铁酸铜(CuFe2O4)的流程如下: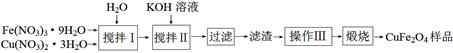
搅拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2的物质的量浓度分别为2.6 mol·L-1、 1.3 mol·L-1。
①搅拌Ⅰ所得溶液中Fe元素的存在形式有Fe3+和 (填化学式)。
②搅拌Ⅱ要跟踪操作过程的pH变化。在滴加KOH溶液至pH=4的过程中(假设溶液体积不变),小组同学绘制溶液中c(Fe3+)、c(Cu2+)随pH变化的曲线如下图,其中正确的是 (用“A”、“B”填空)。
(已知:Ksp[Fe(OH)3]=2.6×10-39、Ksp[Cu(OH)2]=2.2×10-20)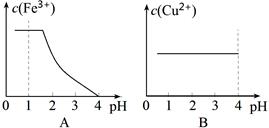
③操作Ⅲ为 、 。
ⅱ.在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
④氧缺位体与水反应制氢的化学方程式为 。
⑤课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)= 。
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加
和
,即可得到
,该反应的还原产物为。
(2)上述浓缩液中含有
、
等离子,取一定量的浓缩液,向其中滴加
溶液,当
开始沉淀时,溶液中
为:,已知
=1.8×10-10,
=8.5×10-17。
(3)已知反应
的
,1
、1
分子中化学键断裂时分别需要吸收436
、151
的能量,则1
分子中化学键断裂时需吸收的能量为
。
(4)
研究了下列反应:

在716
时,气体混合物中碘化氢的物质的量分数
与反应时间
的关系如下表:
| 0 |
20 |
40 |
60 |
80 |
120 |
|
| 1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
|
| 0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:。
②上述反应中,正反应速率为
正=
正·
,逆反应速率为
逆=
逆·
,其中
正、
逆为速率常数,则
逆为(以
和
正表示)。若
正 = 0.0027
,在
=40
时,
正=
③由上述实验数据计算得到
正~
和
逆~
的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母)

酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,,
和
等组成的糊状填充物,该电池在放电过程产生
,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(/100
水)

| 化合物 |
|||
| 10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为,电池反应的离子方程式为
(2)维持电流强度为0.5,电池工作五分钟,理论上消耗
。(已经
=96500
)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有和
,二者可通过分离回收;滤渣的主要成分是
、和,欲从中得到较纯的
,最简便的方法是,其原理是。
(4)用废电池的锌皮制备的过程中,需去除少量杂质铁,其方法是:加稀硫酸和
溶解,铁变为,加碱调节至
为时,铁刚好完全沉淀(离子浓度小于1×10-5
时,即可认为该离子沉淀完全);继续加碱调节至
为时,锌开始沉淀(假定
浓度为0.1
)。若上述过程不加
后果是,原因是。
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72—和CrO42—工业废水的一种常用方法,其工艺流程为:
其中第I步存在平衡:2CrO42—(黄色)+2H+ Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
①若平衡体系的pH=2,该溶液显 色。
②根据2CrO42—+2H+ Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
③第Ⅱ步反应的离子方程式: ,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cr(OH)3]=6.0x10—31)。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是 (填化学式)。
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
Ⅰ:WO42-(aq) + Ca(OH)2(s)  CaWO4(s) + 2OH-(aq)。
CaWO4(s) + 2OH-(aq)。
(1)下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。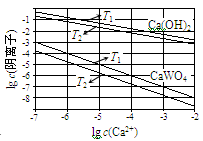
①计算T1时KSP(CaWO4)= ________。
②T1________ T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如下表:
| 温度/℃ |
25 |
50 |
90 |
100 |
| K |
79.96 |
208.06 |
222.88 |
258.05 |
①该反应平衡常数K的表达式为________。
②该反应的△H________0(填“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4) =" c(NaOH)" =" 0.5" mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:________。
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: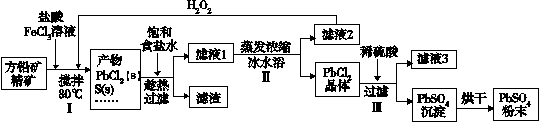
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)有关物质的Ksp和沉淀时的pH如下:
| Ksp |
|
开始沉淀时pH |
完全沉淀时pH |
|
| PbSO4 |
1.08×10-8 |
Fe (OH)3 |
2.7 |
3.7 |
| PbCl2 |
1.6×10-5 |
Pb(OH)2 |
6 |
7.04 |
(1)步骤Ⅰ中生成PbCl2的离子方程式_______,加入盐酸控制pH值小于2,原因是_______。
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因______。若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______。
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式______。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因______。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为_______。
(6)双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是____。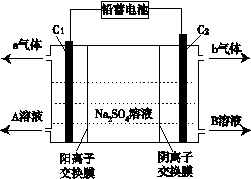
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取:SO2(g)+Cl2(g)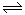 SO2Cl2(g)△H
SO2Cl2(g)△H
针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)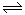 2SOCl2(g)△H1=-akJ/mol
2SOCl2(g)△H1=-akJ/mol
②SO2Cl2(g)+SCl2(g) 2SOCl2(g)△H2=-bkJ/mol(a>b>0)
2SOCl2(g)△H2=-bkJ/mol(a>b>0)
则△H=________kJ/mol(用a、b的代数式表示)
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是________(填字母序号)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1 时刻反应达到平衡状态的是(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)若在催化剂作用下,将n molSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P。起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则υ(SO2)= _________。
②此温度下,该反应的K=_________。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是_________。
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式_______________;已知 于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
(13分)某条件下,在2 L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题: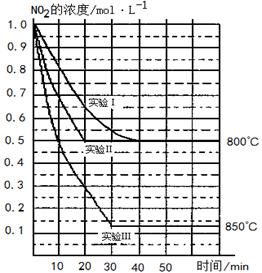
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为 。
(3)800 ℃时,该反应的平衡常数K= ,该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),此时反应将向 进行(填“正反应方向”或“逆反应方向”)。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,
如:8NH3+6NO2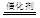 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
(6)向AlCl3溶液中逐滴加入氨水,发生如下反应Al3++3NH3·H2O Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH="4.7" ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH="4.7" ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。














催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s) +8SO2(g) △H=―3412 kJ·mol-1
2SO2(g)+O2(g) 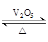 2SO3(g) △H=―196.6 kJ·mol-1
2SO3(g) △H=―196.6 kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H=―130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为 kJ。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为 。
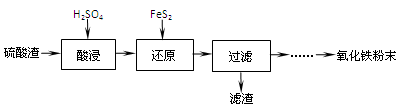
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
I.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为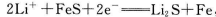 ,则该电池的总反应式为_____________________。
,则该电池的总反应式为_____________________。
Ⅱ.锂一黄铁矿高容量电池,由于其污染小、成本低、电容量大、黄铁矿储备丰富而有望取代目前市场的碱性电池。制取高纯度黄铁矿的工艺流程如下: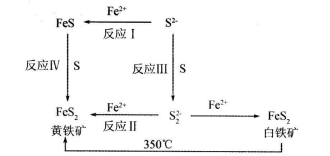
(1)已知: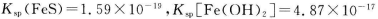 ,为得到较纯的FeS沉淀,最好在FeCl2溶液中加入的试剂为_________(填序号)
,为得到较纯的FeS沉淀,最好在FeCl2溶液中加入的试剂为_________(填序号)
A.(NH4)2S B.CuS C.H2S D.Na2S
(2)关于白铁矿与黄铁矿下列判断错误的是_____________(填序号)
A.属于同素异形体
B.因为晶体结构不同而导致性质有差别
C.黄铁矿比白铁矿更稳定
(3)反应Ⅲ制取 S22-时,溶液必须保持为碱性,除了S2- 与酸反应外,还有更重要的原因是(用离子方程式表示)___________________________.
(4)室温下,Li/FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是____________________________________.
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等。请写出化学反应方程式:
第一次放电:__________________;第二次放电:__________________________。
(5)制取高纯度黄铁矿的另一种方法是:以LiCl- KC1低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解。写出阳极反应式___________________________。
【改编】(16分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)(1)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;腐蚀废液回收得到金属铜还需要的试剂为 。
(2)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(3)下表中,对陈述I、II及其有无因果关系的判断,都正确的是_____(填字母)
| 选项 |
陈述I |
陈述II |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
| B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
I对;II对;无 |
| C |
铁属于过渡金属元素 |
铁和铁的某些化合物可以用作催化剂 |
I错;II对;无 |
| D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
I对;II对;有 |
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:


已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(4)步骤②中加双氧水的目的是 ,pH控制在3.4的作用是 。已知25°C时, ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(5)如何判断步骤③中沉淀是否洗涤干净?___________________________
(6)制备氮化铁磁粉的反应: (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
软锰矿(主要成分为Mn02)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先缎烧软锰矿生成Mn304,再利用铝热反应原理由Mn3O4
制备锰。该铝热反应的化学方程式为
(2)现代冶炼金属锰的一种工艺流程如下图所示:

①软锰矿还原浸出的反应为:
该反应中,还原剂为 。写出一种能提高还原浸出速率的措施:
②滤液1的pH (填“>”“<”或“=”)MnS04浸出液的pH.
③加入MnF2的目的是除去 ( ”)。
”)。
(3)由MnS04制取MnC03。
往MnS04溶液中加人NH4HC03溶液,析出MnC03沉淀并逸出C02气体,该反应的离子方程式为 ;若往MnS04溶液中加人(NH4)2C03溶液,还会产生Mn(OH) 2,可能的原因有: ,
,
t℃时,该反应的平衡常数K= (填数值)。
(15分)重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Al(OH)3 |
Cr(OH)3 |
| pH |
3.7 |
9.6 |
11.1 |
8 |
9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O 转移4.8 mol e-,该反应离子方程式为________________。
转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O 的废水:
的废水:
该法用Fe作电极电解含Cr2O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O 转化为Cr3+的离子方程式为___________________。
转化为Cr3+的离子方程式为___________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5 mol·L-1。
试题篮
()