航天飞机常用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-==CO32-+3H2O。
(1)负极上的电极反应为 。
(2)消耗16.8 L(标准状况下)O2时,有 mol 电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度 (填“增大”、“减小”或“不变”)。
已知反应AsO43—+2I—+2H+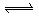 AsO33—+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是
AsO33—+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是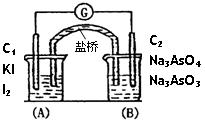
A.两次操作过程中指针偏转方向相同
B.两次操作过程中指针偏转方向相反
C.(Ⅰ)操作过程中C2棒上发生的反应为:AsO43—+2e—+2H+= AsO33—+H2O
D.(Ⅱ)操作过程中C1棒上发生的反应为:2I——2e— = I2
某装置如图所示,下列有关叙述正确的是 ( )
| A.该装置为电解池 |
| B.用铜导线代替盐桥,该装置依然能正常工作 |
| C.该装置中总反应为;Cu+2Ag+=Cu2++2Ag |
| D.Ag一极的反应为:2H++2e一=H2↑ |
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。
试回答:
(1)B装置中Cu电极上的电极反应式为 ,D装置中Fe电极上的电极反应式为 ;
(2)D装置中的实验现象有 ,若用电流表测量反应时通过导线的电子流量为0. 2mol,则Fe电极的质量变化为 ;
(3)比较四个装置中Fe片被腐蚀的速率由快到慢的顺序是 (用A、B、C、D表示)。
普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-= 2NH3+H2。根据以上所述判断下列结论不正确的是
| A.工作时Zn为负极,发生还原反应 |
| B.工作时电流由碳极经外电路流向Zn极 |
| C.输出电流时碳棒上发生还原反应 |
| D.长时间使用后内装糊状物可能流出,腐蚀用电器 |
在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如图所示:
(1)该反应还可用______________代替二氧化锰做催化剂加快反应速率。
(2)A、B、C各点所表示的反应速率由快到慢的顺序为______________。
试解释反应速率变化的原因是__________________________。
(3)该H2O2水溶液的物质的量浓度为_____________________________。
将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
| 金属 |
电子流动方向 |
电压/V |
| Fe |
Fe → Cu |
+0.78 |
| Zn |
Zn → Cu |
+1.10 |
| A |
Cu → A |
-0.15 |
| B |
B → Cu |
+0.3 |
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越___________(填“大”、“小”)。
Zn、A、B三种金属活动性由强到弱的顺序是__________________________。
(2)Cu与A组成的原电池,_____为负极,此电极反应式为___________________。
(3)A、B形成合金,露置在潮湿空气中,_______先被腐蚀。
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,负极电极反应式为:C2H6+18OH-→2CO32-+12H2O+14e-,下列叙述中不正确的是( )
| A.正极发生反应是:O2+2H2O+4e-→4OH- |
| B.参加反应的C2H6与O2的物质的量之比为7:2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.在电解质溶液中阳离子向正极移动 |
某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池组成是( )
| A.正极为铁,负极为铜,电解质溶液为FeCl3溶液 |
| B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 |
| C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为银,负极为铁,电解质溶液为CuSO4溶液 |
在理论上可用于设计原电池的化学反应是( )
| A.2Al(s)+2NaOH(aq)+2H2O(1) = 2NaAlO2(ag)+3H2(g)△H <0 |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) △H >0 |
| C.CaC2(s)+2H2O(1) = Ca(OH)2(s)+C2H2(g)△H <0 |
| D.HCl(aq)+NaOH(aq) = NaCl(aq) + 3H2O(l)△H <0 |
|
A、B、C都是金属,A中混有C时,A先腐蚀;A与B组成原电池时,A为电池的正极,则A、B、C三种金属的活动性顺序为 ( )
A.A>B>C B.A>C>B C.B>A>C D.B>C>A试题篮
()