固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过。其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是 ( )

A.电极b为电池负极,电极反应式为O2+4e- 2O2-
2O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e- 2H++H2O
2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e- 2CO2+2H2O
2CO2+2H2O
某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是
| A.铁 | B.铜 | C.铝 | D.镁 |
在理论上可用来设计原电池的反应是
| A.Fe +2HCl =" Fe" Cl2+ H2 |
| B.NaOH +HCl="NaCl+" H2O |
| C.Cu SO4 +2NaOH= Cu(OH)2+Na2 SO4 |
| D.Ca CO3+2HCl=" Ca" Cl2+ H2O+ CO2 |
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A.A>B>E>D B.A>B>D>E C.D>E>A>B D.D>A>B>E
以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.010 mol,则阴极上析出Cu的质量为
| A.0.64 g | B.5.12 g | C.2.56 g | D.1.28 g |
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述稀硫酸中插入铜片,没有看到有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确的是( )
| A.实验①、②说明锌能与稀硫酸反应而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验④说明该原电池中铜为正极、锌为负极 |
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
| A.电流由O2所在的铂电极流出 |
| B.该电池的负极反应式为:CH3CH2OH+3H2O -12e-=2CO2↑+12H+ |
| C.O2所在的铂电极处发生还原反应 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
下列说法正确的是
| A.流水、风力是一次能源,电力、蒸汽是二次能源 |
| B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池 |
| C.铅蓄电池是一次电池,氢氧燃料电池是二次电池 |
| D.同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是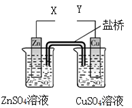
| A.X和Y与电流表连接,电子由Cu极流向Zn极 |
| B.X和Y与电流表连接,将Zn换成Fe测得电流更大 |
| C.X和Y分别与电源“—”、“+”极相连,Cu极质量减轻 |
| D.X和Y分别与电源“—”、“+”极相连,Zn极质量减轻 |
下列关于右图所示原电池装置的叙述中,正确的是( )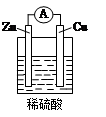
| A.铜片是负极 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
有关原电池的判断正确的是( )
| A.比较活泼的金属一定做负极,活泼性较弱的金属一定做正极 |
| B.原电池的正、负极材料不一定都参与反应 |
| C.原电池的正极在放电后质量一定增加 |
| D.原电池的正极是电子流 |
某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3 |
| B.正极为C,负极为Fe,电解质溶液为Fe(NO)3 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 |
| D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 |
试题篮
()