.铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,
PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;
PbO2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为_ _。若电解液中不加入Cu(NO3)2,主要缺点是 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(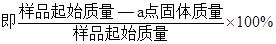 )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO )为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO
)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO -52e-===34CO2+10H2O。
-52e-===34CO2+10H2O。
试回答下列问题:
(1)该燃料电池的化学反应方程式为______________________________________________;
(2)正极电极反应式为____________________________________________。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是________,它来自____________。
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水:
①写出反应的离子方程式_______________________________________。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为_______________________________________________________________。
③若电解后得到200 mL 3.25 mol·L-1 NaOH溶液,则消耗C4H10的体积在标准状况下为________mL。
(9分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 ,水既不做氧化剂又不做还原剂的是 。
| A.2F2+2H2O=4HF+O2 | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数为 。
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
(共8分)
(1)2.00g C2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,请写出表示C2H2燃烧热的热化学方程式: ;
(2)C2H2可用于制作燃料电池,请写以KOH溶液为电解质溶液的乙炔燃料电池的负极反应式: ;
(3)用乙炔燃料电池电解AgNO3溶液,用石墨做电解池两极,请写出与电源负极相连的石墨电极的电极反应式: ;
(4)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH。请写出该电池在充电时阴极的电极反应式: ;
3Zn(OH)2 + 2Fe(OH)3 + 4KOH。请写出该电池在充电时阴极的电极反应式: ;
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
在阳极区发生的反应包括 和H ++ HCO3- ="=" H2O + CO2↑。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) +  O2(g) ="==" H2O(g) Δ H1= —242 kJ·mol-1
O2(g) ="==" H2O(g) Δ H1= —242 kJ·mol-1
CH3OH(g) + O2(g) ="==" CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
O2(g) ="==" CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
①写出CO2和H2生成气态甲醇等产物的热化学方程式 。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。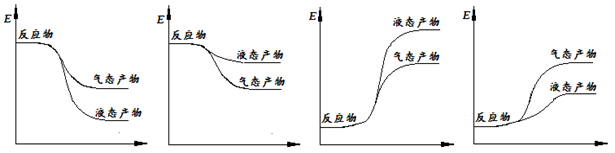
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应式为 。
聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) |
Ala/% |
Alb/% |
A1c/% |
| 0.208 |
1.4 |
86.6 |
12.0 |
| 0.489 |
2.3 |
86.2 |
11.5 |
| 0.884 |
2.3 |
88.1 |
9.6 |
| 1.613 |
3.1 |
87.0 |
9.9 |
| 2.520 |
4.5 |
88.2 |
7.3 |
①在一定温度下,AlT越大,pH (填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图20—1。当T>80℃时,AlT显著下降的原因是 。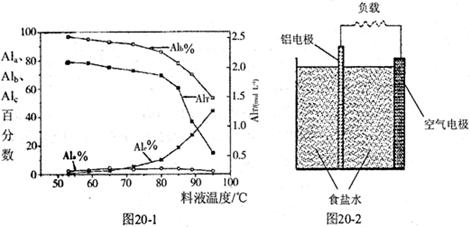
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g) △H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g) △H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图20-2所示,写出该电池正极的电极反应式 。
【化学——选修2:化学与技术】
有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:
(1)“焙烧1”通入空气的目的是使有机化合物、活性炭等可燃物通过燃烧而除掉,通入空气过多反而不利于实现目的,其原因是 。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:___ 。
(3)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是 (写化学式)。
(4)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室检测溶液pH的操作方法是: 。
(5)“焙烧2”的目的是: 。
(6)与焙烧2产生的气体组成元素相同的化合物是 ,该物质与空气形成一种环保型碱性燃料电池,其负极反应式为______________________________。
(7) Pd中加入王水的反应可以表示为Pd+HCl+HNO3→A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。则A的化学式为 。
(12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石
(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是
可燃性气体,则其反应的化学方程式为 。 该可燃气体在酸性
条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
① 原电池反应:
负极:2Fe-4e-=2Fe2+、正极: ;
② 氢氧化物的形成: Fe2 + + 2OH-=" Fe(OH)" 2↓ 。
③ 氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),
铁制品表面发生的电极反应式 为 。
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO +2I-+2H+
+2I-+2H+ AsO
AsO +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是
| A.甲组操作时,电流计(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变浅 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为 |
I2+2e-===2I-
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物。已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1;18.0 g水蒸气液化时的能量变化为44.0 kJ。 
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式 。
(2)在一定条件下,向体积固定为2 L的密闭容器中充人0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图所示。3 min时改变条件,反应进行到4 min时,体系中各物质的物质的量如下表所示:
| t/min |
n(CH4)/mol |
n(H2O)/mol |
n(CO)/mol |
n(H2)/mo1 |
| 4 |
0.18 |
0.38 |
0.22 |
0.66 |
则3~4min之间,平衡向 (填“正”或“逆”)反应方向移动,3min时改变的条件是 。
(3)已知温度、压强和碳水比 对该反应的影响如图所示。
对该反应的影响如图所示。
①图1中,两条曲线所示温度的关系:t1 t2(填“>”、“<”或“=”,下同)
②图2中,两条曲线所示碳水比的关系:x1 x2
③图3中,两条曲线所示压强的关系:p1 p2
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
①放电时,正极的电极反应式为
②假设装置中盛装100.0 mL 3.0mol·L-1KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为 。
下图是一种航天器能量储存系统原理示意图。下列说法正确的是( )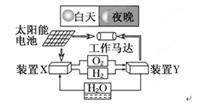
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式 。
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)已知白磷、红磷燃烧的热化学方程式分别为
P4(s,白磷)+ 5O2=P4O10(s);ΔH=–2986kJ·mol-1
4P(s,红磷)+ 5O2=P4O10(s);ΔH=–2956kJ·mol-1
则白磷比红磷 (填“稳定”或“不稳定”)
(4) 已知一定条件下A2与B2自发反应生成AB3,则反应
A2(g)+3B2(g)=2AB3(g) 的ΔS= 0,ΔH 0 (填“<”、“>”、“=”)
(5)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗 银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 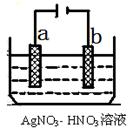
I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)="0.9" mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:
( CO2 + 3H2 = CH3OH + H2O ),并开发出直接以甲醇为燃料的燃料电池。
已知 H2(g)、 CO(g) 和 CH3OH(l) 的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是________(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的
平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 ( 用 a表示 )
(4)已知甲醇燃烧的化学方程式为2CH3OH +3O2 =2CO2 +4H2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为
试题篮
()