(10分) )氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)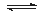 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T |
298 K |
398 K |
498 K |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
A.2v(H2)正=3v(NH3)逆 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡常数_____。(填“增大”、“减小”或“不变”)
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)____ Ksp(AgBr) (填“>”、“=”或“<”)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式____________________。
X、Y、Z三种元素常见单质在常温下都是气体,在适当条件下可发生如下图所示变化,X、Y、Z为三种短周期元素,它们的原子序数之和为16.
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
c.达到化学平衡时,Y的单质的体积分数仍为50%
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
A.调节pH可以改变反应的方向
B.pH = 0.68时,反应处于平衡状态
C.pH = 5时,负极电极反应式为2I--2e- =I2
D.pH >0.68时,氧化性I2〉AsO43-
以食盐为原料进行生产并综合利用的某些过程如下图所示。
除去粗盐中的 、
、 和
和 离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
A.  B.
B.  C.
C. 
(2)将滤液的 调至酸性除去的离子有___________________。
调至酸性除去的离子有___________________。
(3)人们习惯上把电解饱和食盐水的工业叫做氯碱工业。下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是_____,在X极附近观察到的现象是________________;Y电极上的电极反应式是______,检验该电极反应产物的方法是_______________ 。电解 溶液的离子方程式是_____________________。
溶液的离子方程式是_____________________。
(4)若向分离出 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
(5)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气的电极为 (填“正极”或“负极”),负极的电极反应式为 。
②石墨电极为 (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_ 区(填“铁极”或“石墨极”)的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 ,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为______________。
④若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为 ;丙装置中阴极析出铜的质量为 。
利用下图装置可以模拟铁的电化学防护。下列说法不正确的是
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于M处,铁极发生氧化反应 |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀 |
| D.若X为碳棒,开关K置于N处,X极发生氧化反应 |
Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
(1)实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu  Cu(NO3)2 乙:Cu
Cu(NO3)2 乙:Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
①从绿色化学的角度分析, 同学的方案更合理,此同学可节约2mol/L的稀硝酸 mL;
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
方案(填字母序号)。
③有下述装置(如下图),当装置电路中通过2mol电子时,Cu电极(填编号) 。
(a)增重64g (b)减重64g (c)可能增重64g,也可能减重64g
(2)①某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式: ;
②在装置中①试管的橡皮塞最好用锡箔包住,原因是 。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
如图所示3套实验装置,分别回答下列问题。
(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是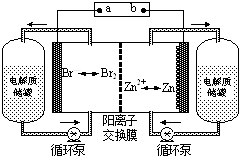
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙。则下列叙述正确的是( )
| A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能 |
| B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 |
| C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同 |
| D.甲、乙中溶液的pH逐渐升高,丙中溶液的pH逐渐减小 |
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①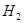 ②
②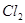 ③
③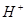 ④
④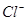 ⑤
⑤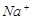 ⑥
⑥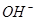
⑵写出在电解过程中阳极发生的电极方程式: 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
写出在电解过程中阳极发生的电极方程式 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
(5)如图所示的是一个燃料电池的示意图,当此燃料电池工作时,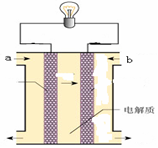
①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式:
②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH  2K2CO3+6H2O
2K2CO3+6H2O
(1)甲电池是 装置,A(石墨)电极的名称是 。
(2)写出电极反应式:
通入CH3OH的电极的电极反应式是 。
B(Ag)电极的电极反应式为 ,
(3)乙池中反应的总反应方程式为 。
(4)当乙池中A(Ag)极的质量增加5.40g时,甲池中理论上消耗O2
mL(标准状况下)。
直接NaBH4/H2O2燃料电池(DBFC)的结构如图,有关该电池的说法不正确的是( )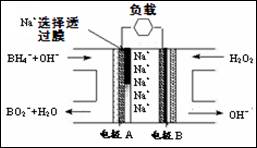
A.电极B材料中包含MnO2层,MnO2可起催化作用
B.电池负极区电极反应: BH4-+8OH--8e-=BO2-+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L6mol/LH2O2溶液,理论上流过
电路中的电子为12NA个
(12分)碳元素的单质及其化合物与人类的生产、生活、科研息息相关。请回答下列问题:
(1)绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s)=4(C3H6O3)+(s)+O2(g)+4e- △H="1360" kJ·mol-1
12(C3H6O3)+(s)+12e-=C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H="-1200" kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为
。
(2)工业上利用水煤气合成甲醇的主要反应可表示为:
H2(g)+1/2CO(g) 1/2CH3OH(g) △H=-45.4kJ·mol-1。
1/2CH3OH(g) △H=-45.4kJ·mol-1。
向容积为1L的密闭容器中加入0.10 mol H2和0.05mol CO,在一定温度下发生上述反应, 10min后反应达到平衡状态,测得放出热量3.632kJ。
①该温度条件下,上述反应的化学平衡常数K= 。
②若容器容积不变,下列措施可增加CH3OH产率的是 (填写序号)。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入O.10 mol H2和0.05mol CO |
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向 (填“逆向”、“正向”或“不”)移动,化学平衡常数K (填“增大”、“减小”或“不变”)。
(3)已知反应:2CO(g)+O2(g)=2CO2(g) △H<0,根据原电池原理该反应能否设计成燃料电池。若能,请写出当电解质溶液为KOH溶液时的负极反应式(若不能,该空可不作答): 。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
| 周期 |
ⅠA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
|
|
⑦ |
⑧ |
|
(1)请画出元素⑥的离子结构示意图: 。
(2)元素⑦中质子数和中子数相等的同位素符号是: 。
(3)④、⑤、⑦的离子半径由大到小的顺序为: 。
(4)②的最高价氧化物对应水化物的电离方程式为: 。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为: 。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为: 。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程 。
试题篮
()