燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。
请根据图示回答下列问题:
(1)图中a电极是 (填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为 。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为 。
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是 。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式: 。
铅蓄电池属于二次电池,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸,工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;PbSO4不溶。
(1)该蓄电池工作时负极的电极反应式为
(2)若该电池工作时,电路中有2 mol 电子通过,则消耗了H2SO4的物质的量为
(3)将质量相等的铁棒和石墨棒分别插入CuSO4溶液中,铁棒接该蓄电池Pb极,石墨棒接该蓄电池PbO2极,一段时间后测得铁棒比石墨棒增加了3.2克,则CuSO4溶液质量 (增加、减少) 克;如果要求将CuSO4溶液恢复成与开始时完全相同的状态,则可以加入下列物质中的
A CuSO4溶液 B CuCO3固体 C CuO固体
D Cu(OH)2固体 E.Cu固体 F. Cu2(OH) 2CO3固体
(4)若用该蓄电池作电源(都用惰性材料做电极)电解400克饱和食盐水,如果电路内通过电子为1mol时, 理论上可得到氯气在标准状况下的体积为 。
下图是一个电化学过程的示意图。
I.在甲池中,若A端通入甲醇,B端通入氧气,丙池中装有溶质质量分数为10. 00%的Na2SO4溶液100 g,过一段时间后,丙池中溶质的质量分数变为10.99%。
(1)此时A端为电源的________极(填“正”或“负”),A极的电极反应式为:________________。
(2)若乙池溶液的体积为1 L,则此时乙池溶液中c(H+)=______________(不考虑Ag+的水解)。
(3)丙池中产生的气体体积为________L。(标准状况下)
Ⅱ.制取KMnO4的最好方法是电解K2MnO4,若此时把丙池中阳极材料换为铂板,阴极材料换为铁板,硫酸钠溶液换成K2MnO4溶液,则可制取KMnO4。
(4)阳极的电极反应式为____________________________________________________________。此时溶液的pH_________(填“增大”、“减小”或“不变”)。
(1)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为 极,该极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(3)碘被称为 “智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,可通过电解制备碘酸钾。(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为 。
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是 ( )
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:3Zn+2K2FeO4+8H2O 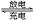 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A.放电时负极反应为:3Zn — 6e-+6OH- ="=" 3Zn(OH)2 |
| B.放电时OH-向正极移动 |
| C.充电时每转移3 mol电子,阳极有1 mol Fe(OH)3 被还原 |
| D.充电时阳极反应式为:3Zn(OH)2+6e- ="=" 3Zn+6OH- |
下图是一个电化学过程的示意图。
请回答下列问题:
(1)图中甲池是________(填“原电池”“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”“负极”“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_________ ____。
(4)乙池中反应的化学方程式为_____ ___,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________。
| A.MgSO4 | B.CuSO4 | C.Pb(NO3)2 | D.AgNO3 |
氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH)  2Ni(OH)2。下列叙述正确的是
2Ni(OH)2。下列叙述正确的是
| A.电池放电时,电池负极周围溶液的pH不断增大 |
| B.电解质溶液可以是稀硫酸 |
| C.外电路中每通过0.2mol电子,H2的质量理论上减小0.2g |
| D.电池工作时,电子由正极通过外电路流向负极 |
(14分)某含铬的污水可用下图所示装置处理,该装置可将污水中的Cr2O72-还原为Cr3+。
(1)图中左右两个装置中, (填“左”或“右”)装置为电解池。电源中负极的活性物质为 (填化学式);电源中两电极间,带负电荷的离子运动的方向为 (填“从左至右”或“从右到左”),该离子为 (填化学式)。
(2)请写出阳极上的电极反应式及Cr2O72-被还原为Cr3+的离子方程式分别是:
、 。
(3)为保证正常工作,图中A物质必须循环使用,其化学式为: 。
(4)镧系元素均为稀土元素(常用作电极)位于元素周期表第六周期,该周期元素形成的氢氧化物中碱性最强的为 (填写化学式)。铈(Ce)有两种氢氧化物Ce(OH)3和Ce(OH)4,前者对空气比较敏感,请用化学方程式表示其原因 。
(本题15分)
I.已知:反应
4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH =" —115.6" kJ/mol
2Cl2(g)+2H2O(g) ΔH =" —115.6" kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ΔH =" —184" kJ/mol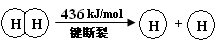

(1)H2与O2反应生成气态水的热化学方程式是 。
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: ,它所对应的化学方程式为: .
,它所对应的化学方程式为: .
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:
A(g) + 3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
| T/K |
300 |
400 |
500 |
… |
| K/(mol·L-1)2 |
4×106 |
8×107 |
K1 |
… |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。 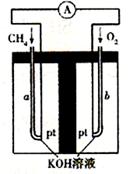
①放电时,负极的电极反应式为 。
②假设装置中盛装100.0 mL 3.0 mol·L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系
为 。
(14分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接全部仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。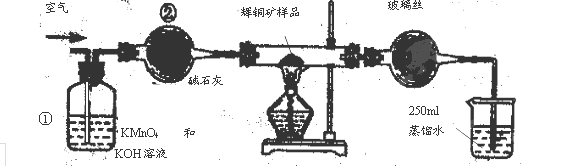
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.04 |
21.03 |
| 2 |
25.00 |
1.98 |
21.99 |
| 3 |
25.00 |
3.20 |
21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6.25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1.0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
(6)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.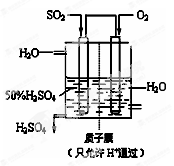
(12分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。
回答下列问题:
(1)P的电子式是_________________;
(2)C元素原子价电子排布式为: 。
(3)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极反应式:
_______________________________________________________________;
(4)A的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式和必要的文字说明原因______________________________________________________________
(5)用惰性电极电解400.00 mL A溶液,一段时间内测得溶液pH=1,则需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
(8分) X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是____________。
(2)Z2Y2与X2Y反应的化学方程式是__________________________________。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是____________(填写“正极”或“负极”)。
C(Ⅱ)的电极反应式是__________________________________。
(4)铜屑放入稀硫酸不反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是__________________________________。
(每空2分,16分)
Ⅰ.2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行t1时刻达到平衡状态的是 (填代号)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H1=-867 kJ/mol ①
2NO2(g)  N2O4(g) △H2=-56.9 kJ/mol ②
N2O4(g) △H2=-56.9 kJ/mol ②
H2O(g) = H2O(l) ΔH3= -44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子符号);A、B、C三种元素按1:7:12的质量比组成的化合物中含有的化学键的类型属于 。
(2)某金属常用于制作易拉罐,该金属制作的废弃易拉罐能与 A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(3)A、C两元素的单质与烧碱溶液组成燃料电池,其负极反应式为 ,用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA2时, 所得溶液在常温下的PH= (假设电解过程中溶液的体积不变) 。
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧热的热化学方程式: _________________________。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为_____ ________。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z + FeG2  Fe + 2ZG
Fe + 2ZG 
放电时,电池的正极反应式为_____________:充电时,____________(写物质名称)电极接电源的负极;该电池的电解质为___________________。
试题篮
()