下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn - MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述稀硫酸中插入铜片,没有看到有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确的是
| A.实验①、②说明锌能与稀硫酸反应而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验④说明该原电池中铜为正极、锌为负极 |
下列判断中正确的是
| A.烧杯a中的溶液pH升高 | B.锌是化学电源的正极 |
| C.烧杯a中发生的反应为2H++2e-=H2↑ | D.盐桥中的阳离子向铁电极移动 |
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
| A.图1为原电池装置,Cu电极上产生的是O2 |
| B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-= Cu2+ |
| C.由实验现象可知:金属活动性Cu>Cr |
| D.两个装置中,电子均由Cr电极流向Cu电极 |
如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色。下列说法中正确的是( )
| A.X是正极,Y是负极 | B.U型管中溶液PH值逐渐变小 |
| C.CuSO4溶液的pH逐渐减小 | D.CuSO4溶液的pH保持不变 |
X、Y、Z、M、N代表五种金属。有如下化学反应,(1)水溶液中:X+Y2+=X2++Y (2)Z+2H2O(冷)=Z(OH)2+H2
(3)M、N为电极,与N的盐酸溶液组成原电池,发生的电极反应为:M-2e—=M2+
(4)Y可以溶于稀H2SO4中,M不被稀H2SO4氧化。则金属性强弱顺序正确的是( )
| A.M<N<Y<X<Z | B.N<M<X<Y<Z |
| C.N<M<Y<X<Z | D.X<Z<N<M<Y |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn +2K2FeO4 +8H2O 3Zn(OH)2 +2Fe(OH)3 + 4KOH, 不正确的是( )
3Zn(OH)2 +2Fe(OH)3 + 4KOH, 不正确的是( )
| A.放电时负极反应为:Zn – 2e- + 2OH- = Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- = FeO42- + 4H2O |
| C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
把a、b、c、d四块金属浸入稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时a溶解;c、d相连时c为负极;a、c相连时,c极上产生大量气泡;b、d相连时,b为正极,则四种金属活动性顺序由强到弱为( )
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如下图所示。最先观察到变为红色的区域为( )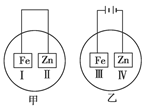
| A.Ⅰ和Ⅲ | B.Ⅰ和Ⅳ | C.Ⅱ和Ⅲ | D.Ⅱ和Ⅳ |
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中正确的是 
| A.燃料电池工作时,正极反应为:O2+2H2O+4e一=40H— |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
关于原电池和电解池的叙述正确的是。
| A.原电池中失去电子的电极为阴极 |
| B.原电池的负极、电解池的阳极都发生氧化反应 |
| C.原电池的两极一定是由活动性不同的两种金属组成 |
| D.电解时电解池的阴极一定是阴离子放电 |
常用的钮扣式银锌电池,放电时的电极反应式分别为:
Zn极:Zn+2OH-+2e- = Zn(OH)2 Ag2O极:Ag2O+H2O+2e- =2Ag+2OH-则下列说法中不正确的是( )
| A.放电过程中[OH-]不变 | B.Zn为负极而Ag2O为正极 |
| C.电解质溶液呈碱性 | D.电子从Ag2O流出经用电器流入Zn极 |
极反应式与出现的环境相匹配的是( )
| 选项 |
电极反应式 |
出现的环境 |
| A |
O2 + 2H2O + 4e- =" " 4OH- |
碱性环境下氢氧燃料电池的负极反应 |
| B |
4OH- - 4e- = O2↑+ 2H2O |
弱酸性环境下钢铁的吸氧腐蚀 |
| C |
2H+ + 2e- =H2↑ |
用铜做电极电解NaOH溶液的阴极反应 |
| D |
H2 – 2e- = 2H+ |
用惰性电极电解H2SO4溶液的阳极反应 |
试题篮
()