.有A、B、C、D四块金属片,用导线两两连接插入稀硫酸中,可以组成各种原电池。若A与B连接时,A为负极;C与D相连时,C溶解,D上有氢气生成;A与C连接时,C为正极;B与D相连时,电子由D极经导线流向B极,则这四种金属的活泼性由强到弱的顺序是
A、ABCD B、ACDB C、CADB D、BDCA
如图所示的原电池中,负极发生的反应是
A. + 2e- ="=" Cu + 2e- ="=" Cu |
B.Cu - 2e- ="="  |
C.2 + 2e- ="=" H2↑ + 2e- ="=" H2↑ |
D.Zn - 2e- ="="  |
如图所示,杠杆AB两端分别持有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入较浓的硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑两球的浮力变化):
| A.当杠杆为绝缘体时,A端高、B端低;为导体时,A端低、B端高 |
| B.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低 |
| C.当杠杆为导体或绝缘体时,均为A端高B端低 |
| D.当杠杆为导体或绝缘体时,均为A端低B端高 |
发生原电池的反应通常是放热反应,下列反应在理论上可设计成原电池的是
| A.C+CO2=2CO |
| B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O |
| C.CaC2+2H2O=Ca(OH)2+C2H2 |
| D.CH4+ 2 O2= CO2 + 2H2O |
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: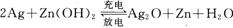 ,在此电池放电时,负极上发生反应的物质是()
,在此电池放电时,负极上发生反应的物质是()
| A.Ag | B.Zn(OH)2 | C.Ag20 | D.Zn |
下列变化是因原电池反应而引起的是
| A.在空气中金属铝表面迅速氧化形成保护膜 |
| B.常温下,铁被浓硫酸“钝化”形成保护膜 |
| C.在潮湿的空气中过氧化钠易变质 |
| D.在潮湿的空气中钢铁易生锈 |
原电池产生电流的本质原因是
| A.原电池中溶液能电离出自由移动的离子 |
| B.有导线将两个活动性不同的电极连接 |
| C.正极发生了还原反应,负极发生了氧化反应 |
| D.电极上进行的氧化还原反应中有电子的转移 |
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
| A.正极附近的SO42―离子浓度逐渐增大 | B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 | D.铜片上有H2逸出 |
随着人们环保意识的增强,废电池必须进行集中处理的问题已经提到议事日程上来,其首要原因是( )。
| A.充电后可再使用 |
| B.回收利用石墨电极和金属材料 |
| C.防止电池中汞、镉和铅等重金属离子污染土壤和水源 |
| D.防止电池中的电解质溶液腐蚀其他物品 |
原电池产生电流的本质原因是
| A.原电池中溶液能电离出自由移动的离子] |
| B.有两根导线将两个活泼性不同的电极连接 |
| C.电极上自发进行的氧化还原反应中有电子的转移 |
| D.电极上进行的氧化还原反应的生成物为电子 |
试题篮
()