下列叙述正确的是( )
| A.铜锌原电池工作一段时间后,铜的质量增加 |
| B.钢铁的吸氧腐蚀负极反应为:Fe-2e====Fe2+ |
| C.电解AlCl3溶液可得到Al |
| D.电镀时应把镀件置于电解池的阳极 |
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用下列物质中的( )
| A.NaOH | B.HCl |
| C.NaCl | D.CuSO4 |
关于如图4-10所示装置的叙述,正确的是( )

图4-10
| A.铜是阳极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
将纯锌片和纯铜片按图所示方式插入相同浓度的稀硫酸中一段时间,以下有关叙述正确的是( )
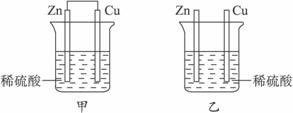
| A.甲装置中电能转化为化学能 | B.乙装置中电能转化为化学能 |
| C.甲装置中铜片表面有气泡产生 | D.乙装置中铜片表面有气泡生成 |
一个原电池总反应为:Zn+Cu2+ Zn2++Cu,该原电池材料及电解质可能是( )
Zn2++Cu,该原电池材料及电解质可能是( )
| |
正极 |
负极 |
电解质溶液 |
| A |
Zn |
Cu |
CuCl2 |
| B |
Cu |
Zn |
H2SO4 |
| C |
Cu |
Zn |
CuSO4 |
| D |
Fe |
Zn |
CuSO4 |
碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2 |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol 电子,锌的质量理论上减小6.5g |
银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,放电时它的正、负两极的电极反应式如下:
Zn+2OH--2e=Zn(OH)2
Ag2O+H2O+2e=2Ag+2OH-
下列判断正确的是( )
| A.锌为负极,氧化银为正极 |
| B.锌为正极,氧化银为负极 |
| C.原电池工作时,负极区溶液pH增大 |
| D.原电池反应的化学方程式为:Zn+Ag2O+H2O=Zn(OH)2+2Ag |
锌锰干电池在放电时总反应方程式可以表示为:Zn(s)+2MnO2+2NH4+ Zn2++Mn2O3(s)+ 2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
Zn2++Mn2O3(s)+ 2NH3↑+H2O,在此电池放电时正极(碳棒)上发生反应的物质是( )
| A.Zn | B.碳 | C.MnO2和NH4+ | D.Zn2+和NH3 |
试题篮
()