在理论上不能用于设计原电池的化学反应是
| A.NaCl(aq)+ AgNO3(aq)= AgCl(s)+ NaNO3(aq )△H<0 |
| B.2CH3OH (l) +3O2(g) = 2CO2(g) + 4H2O (l)△H<0 |
| C.2FeCl3(aq)+Fe(s) = 3FeCl3(aq) △H < 0 |
| D.2H2 (g) + O2 (g) = 2H2O (l) △H < 0 |
将铜片和铝片用导线连接后插入盛有浓硝酸的烧杯中组成原电池,此原电池的负极及其电极反应分别是
| A.Al, Al- 3e-=Al3+ | B.Cu, Cu-2e-=Cu2+ |
| C.Al, 2H++2e-=H2↑ | D.Cu, 2H++NO3-+e-=NO2↑+H2O |
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:
C 2—+2e—→C,B—2e—→B2+则A、B、C、D金属性由强到弱的顺序为( )
A.A>B>C>D B.A>B>D>C C.D>A>B>C D.D>C>A>B
在如图所示的装置中,a的金属活泼性在氢前,b为碳棒,关于此装置的各种叙述不正确的是( )
| A.a是正极,b是负极 |
| B.碳棒上有气体放出 |
| C.a极上发生了氧化反应 |
| D.溶液中H+从a极移动到b极 |
2008年10月8日,瑞典皇家科学院宣布美籍华裔科学家钱永健获得2008年度诺贝尔化学奖.少年时代,他就对化学产生了浓厚的兴趣.16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项.下列说法正确的是( )
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将水库中的水闸(钢板)与外加直接电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C.由原电池原理知所有的合金都比纯金属更易被腐蚀 |
| D.铜板上的铁铆钉处在潮湿的空气中发生:Fe→Fe3++3e-,从而形成铁锈,但此过程铜不被腐蚀 |
纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-→Zn(OH)2+2e- Ag2O+H2O+2e-→2Ag+2OH- 下列说法中正确的是( )
| A.锌是正极,氧化银是负极 | B.锌发生还原反应,氧化银发生氧化反应。 |
| C.溶液中OH-向正极移动,K+、H+向负极移动。 | |
| D.在电池放电的过程中,电解质溶液的酸碱性基本保持不变。 |
把锌片和铁片放在盛有食盐水和酚酞溶液的表面皿中,
如图所示,最先观察到酚酞变红的区域是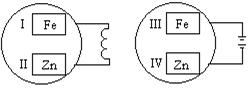
| A.I和III | B.I和IV |
| C.II和III | D.II和IV |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯( )中形成的,电池总反应方程式为:
)中形成的,电池总反应方程式为:
8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是
| A.若电解质溶液中混入水,对电池反应无影响 |
| B.金属锂作电池的正极,石墨作电池的负极 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被氧化为Li2SO3 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 |
磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
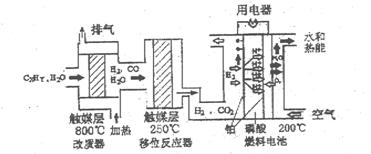
下列说法不正确的是 ( )
|
A.在改质器中主要发生的反应为CXHy+XH2O XCO+(X+Y/2)H2 XCO+(X+Y/2)H2 |
B.移位反应器中CO(g)+H2O(g)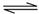 CO2(g)+H2(g) CO2(g)+H2(g)  。温度越高,CO转化率越大 。温度越高,CO转化率越大 |
| C.负极排出的气体主要是CO2 | |
| D.该电池正极的电极反应为O2+4H++4e-=2H2O |
在右图所示的原电池中,负极发生的反应是
| A.Cu2+ + 2e- ="=" Cu | B.Cu-2e- ="=" Cu2+ |
| C.2H+ + 2e- ="=" H2↑ | D.Zn-2e- ="=" Zn2+ |
对于锌-铜-稀H2SO4组成的原电池装置中,当导线中有1mol电子通过时,理论上的电极变化
①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出了1g H2④铜片上析出1molH2
A. ①③ B. ①④ C ②③ D. ②④
某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
A正极为Cu,负极为Fe,电解质为FeCl3溶液
B正极为C,负极为Fe,电解质为Fe(NO3)3溶液
C正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液
试题篮
()