下列有关说法正确的是
| A.S(s,单斜)═S(s,正交) ΔH= +0.33kJ•mol‑1,正交硫比单斜硫稳定 |
| B.2H2(g)+O2(g)═2H2O(g); ΔH=﹣489.6kJ•mol-1,氢气的燃烧热为489.6kJ•mol-1 |
| C.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起到保护作用 |
| D.锌锰干电池工作一段时间后碳棒变细 |
如图所示,利用2Ag + Cl2 = 2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质)。下列分析不正确的是
| A.空气中c(Cl2)越大,Ag极消耗速率越快 |
| B.Ag+向Pt电极移动 |
| C.电子由Ag电极经外电路流向Pt电极 |
| D.Ag电极上发生了还原反应 |
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-="Ag" ③实验过程中取出盐桥,原电池仍继续工作 ④将铜片侵入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
实验发现,298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是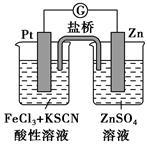
| A.该原电池的正极反应是Zn-2e-=Zn2+ |
| B.左烧杯中溶液的血红色逐渐褪去 |
| C.该电池铂电极上有气泡出现 |
| D.该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+ |
某潜航器使用新型镁-过氧化氢燃料电池系统,其工作原理如图所示。以下说法中错误的是
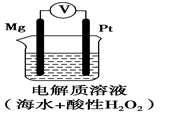
| A.当电路中有2 mol电子转移时,镁电极的质量减轻24 g |
| B.电池工作时,正极上有H2生成 |
| C.工作过程中溶液的pH会增大 |
| D.电池正极的反应式为H2O2+2e-+2H+=2H2O |
综合如图判断,下列说法正确的是
| A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动 |
| D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大 |
图中两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:Fe-2e-=Fe2+,则以下说法不正确的是
| A.该装置可能是电解池 |
| B.a极上一定发生还原反应 |
| C.a、b可能是同种电极材料 |
| D.该过程中能量的转换一定是化学能转化为电能 |
关于如图所示装置的叙述正确的是
| A.电流由锌经导线流向铂,电子由铜经导线流向碳棒 |
| B.碳棒是正极,铜片是阳极 |
| C.锌片的质量逐渐减少,铂片的质量逐渐增加 |
| D.锌片上发生还原反应,碳棒上发生氧化反应 |
下列各组的电极材料和电解液,不能组成原电池的是
| A.铜片、石墨棒,稀硫酸 | B.铜片、石墨棒,硝酸银溶液 |
| C.锌片、铜片,稀盐酸 | D.铜片、银片,FeCl3溶液 |
下列说法正确的是
A.氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl- [CoCl4]2-(蓝色)+6H2O [CoCl4]2-(蓝色)+6H2O△H =akJ·mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 |
| B.用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.为了减小中和滴定的误差,锥形瓶必须洗净并烘干后才能使用 |
| D.右图表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 |

如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是
| A.锌片是负极 | B.两个铜片上都发生氧化反应 |
| C.石墨是阴极 | D.两个番茄都形成原电池 |
在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
| A.外电路的电流方向为X→外电路→Y |
| B.若两电极分别为铁和碳棒,则铁棒进行的电极反应式为2H++2e-=H2↑ |
| C.X极上发生的是还原反应,Y极上发生的是氧化反应 |
| D.若两电极都是金属,则它们的活动性顺序为X>Y |
综合如图判断,下列说法正确的是
| A.装置Ⅰ和装置Ⅱ均是将电能转化为化学能的装置 |
| B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH- |
| C.装置Ⅰ和装置Ⅱ中盐桥中的阴离子均向右侧烧杯移动 |
| D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大 |
试题篮
()