钒()及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)是接触法制硫酸的催化剂.
①一定条件下,与空气反映t
后,
和
物质的量浓度分别为
和
, 则
起始物质的量浓度为mol/L ;生成
的化学反应速率为
.
②工业制硫酸,尾气用吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.

①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由色变为色.
③放电过程中氢离子的作用是和;充电时若转移的电子数为3.01 1023个,左槽溶液中
1023个,左槽溶液中的变化量为.
Ⅰ、某同学根据离子方程式:2Fe3++Cu===2Fe2++Cu2+设计了一套原电池装置,从而实现了该反应。在下面画出该原电池的示意简图(正极材料为碳棒,标明正、负极及电极材料和电解质溶液)。
II 、锌锰干电池是应用最普遍的电池之一(如图所示),其基本反应为:
X极:Zn—2e-====Zn2+
Y极:2MnO2+2NH4++2e-====Mn2O3+2NH3+H2O
Y极是电池的_________(填“正”或“负”)极,若反应消耗16.25gZn,则电池中转移电子的物质的是为________________。
下列关于实验现象的描述,正确的是
① 由铜锌组成的原电池,电子是从锌经过导线流向铜
② 把铜片和锌片紧靠在一起浸入稀硫酸中,铜表面出现气泡
③ 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
④ 把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率加快
航天飞机常用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-==CO32-+3H2O。
(1)负极上的电极反应为 。
(2)消耗16.8 L(标准状况下)O2时,有 mol 电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度 (填“增大”、“减小”或“不变”)。
将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
| 金属 |
电子流动方向 |
电压/V |
| Fe |
Fe → Cu |
+0.78 |
| Zn |
Zn → Cu |
+1.10 |
| A |
Cu → A |
-0.15 |
| B |
B → Cu |
+0.3 |
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越___________(填“大”、“小”)。
Zn、A、B三种金属活动性由强到弱的顺序是__________________________。
(2)Cu与A组成的原电池,_____为负极,此电极反应式为___________________。
(3)A、B形成合金,露置在潮湿空气中,_______先被腐蚀。
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
请回答下列问题:
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,
正极的电极反应式为:
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,
该装置 (填“能”或“不能”)形成原电池,若不能,请说明
理由;若能,请指出正、负极,正极 ,负极
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入 极(填a或b,下同),电子从 极流出。
用导线将锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,此电池的负极是 ,正极的电极反应式是 ,负极的电极反应式是 ,总电极反应式是 。
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: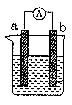
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池的总的离子反应反应方程式:
正极的电极反应式为:
当a极溶解的质量为5.4g时,有 mol电子通过导线
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,
该装置 (填“能”或“不能”)形成原电池,
若不能,请说明理由 (若能该空不作答),
若能,该原电池的正极为 ;该原电池总的化学反应方程式为:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e- ="=" 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题:

(1)将反应Zn + 2H+ ="=" Zn2+ + H2↑拆写为两个“半反应式”:其中,氧化反应式为: 。
(2)由题(1)反应,设计成原电池如图所示:

若电极a为Zn ,电极b可选择材料: (只填一种);
电解质溶液甲是 ;电极b处的电极反应式: 。
(3)由反应2H2 + O2 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:
负极 ,正极 。
(4)以惰性材料为电极,电解100mL PH=6的硫酸铜溶液,当电解池内溶液的PH为1时,电极上析出的铜的质量为 (忽略电解前后溶液体积的变化)。
利用反应Zn +2FeCl3=ZnCl2+2FeCl2,设计一个原电池,在下面画出实验装置图:
并指出正极为 ,电极反应式 ;
负极为 电极反应式为 。
(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_________ ______。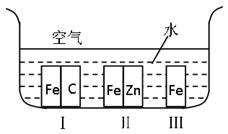
(2)乙烷中含有乙烯除杂试剂为 ;
反应的化学方程式为 。
(3)在10L密闭容器中充入2molA和1molB,发生的化学反应:3A(g)+B(g) 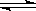 C(g)
C(g)
+2D(g),2min后反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的5/6,试填写下列空白:
①用气体B表示的2min内的平均反应速率为 。
②平衡时,A的浓度为 mol/L。
(4)我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。电池负极反应为 ,
正极反应 。
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/tool
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=一1135.7kJ/mol
则肼完全燃烧的热化学方程式为 。
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,正极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。 (3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
(3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是 。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗 molN2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+) 0.1mol/LHCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H-5、Cl-、OH-、H+离子浓度南大到小的顺序为 。
试题篮
()