某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(填“锌”或“铜”,下同),溶液中的H+ 移向 极,铜极上的电极反应式是 。
(2)若电解质溶液是硫酸铜溶液,铜极上的电极反应式是 ,若反应过程中有0.2mol电子发生转移,则电解质溶液质量增加 g。
由A、B、C、D四种金属按下表中装置进行实验,已知用C与B相连作电极放入硫酸铜溶液中B溶解。根据实验现象填表:
| 装置 |
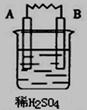 |
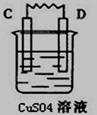 |
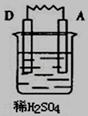 |
| 现象 |
金属A断溶解 |
C的质量增加 |
A上有气体产生 |
| 正极反应式 |
|
|
|
| 四种金属活动性有强到弱的顺序: |
现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A) (B) 。
(2)如果(A或B)不能,说明其原因 。
(3)如果(A或B)可以,则写出正、负极材料及其电极反应式,电解质溶液
负极: ; 。
正极: ; 。
电解质溶液: 。
(5分)某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:

| 实验编号 |
水果种类 |
电极间距离/㎝ |
电流大小/µA |
| ① |
西红柿 |
1 |
98.7 |
| ② |
西红柿 |
2 |
72.5 |
| ③ |
苹 果 |
2 |
27.2 |
(1)该实验的目的是探究水果种类和_______________对水果电池电流大小的影响。
(2)上图所示的装置中,做负极的材料是_______(填“铜片”或“锌片”),该装置能将______转变为电能。
(3)能表明水果种类对电流大小有影响的实验编号是________和__________。
(4)请你再提出一个可能影响水果电池电流大小的因素:__________________________。
某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为 。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
正极反应式: ;负极反应式: 。
若该电池中有0.1mol的电子转移,请问消耗 克Fe
方案Ⅲ.结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): __________________,用离子方程式表示其反应原理:______________
如图甲、乙是电化学实验装置。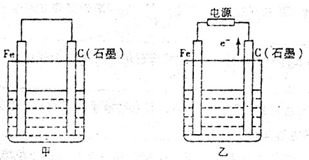
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________________________;
②乙中总反应的离子方程式为___________________________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为_______________________________________________________。
(2)若甲 、乙两烧杯中均盛有CuSO4溶液。
、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为___________________________________________;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入______________(填写物质的化学式)_______________g。
化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号)。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个 原电池。
原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
如右图所示:
(1)将铜棒和铝棒用导线连接后置于盛稀盐酸的烧杯中,看到的现象是 。铝棒做 极,该极的电极反应方程式为 _______ 。
(2)如果将盐酸换成NaOH溶液,该电池发生的总反应离子方程式为_________________。
此时铝棒做 极,该极的电极反应方程式为 。
(3)如果将盐酸换成浓硝酸溶液,则铝棒做 极。
用铜片、锌片和200mL稀H2SO4等组成原电池(如右图)。若整个实验过程有6.5 g锌溶解,此时H2SO4恰好全部用完。回答下列问题:
写出正极的电极反应式 ,正极发生的现象是 ,负极的电极反应式为 。
(2)试计算:铜片上共放出 L气体(标准状况),整个实验过程转移电子 mol,稀硫酸的物质的量浓度为 mol/L。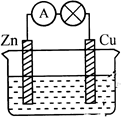
某高二化学兴趣小组为了探究铝电极在原电池中的作用,设计并 进行了以下一系
进行了以下一系 列实验,实验结果记录如下:
列实验,实验结果记录如下:
(1)实验①、⑤中Al电极的作用是否相同 (填“是”或“否”);
(2)请在方框内画出实验③的原电池装置图,标出正、负极。
(3)实验②中电流计指针偏向 电极(填“Al”或“Cu”),Cu电极反应式为 ;
(4)实验④中铝为 极(填“正”或“负”),其电极反应式为 。
由图判断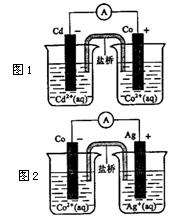
(1)Cd、Co、Ag三种金属的活泼性由强到弱的顺序是________________,
(2)有关盐桥的叙述正确的是_____________(可多选)
A 内盛含琼胶的饱和蔗糖溶液
B 内盛含琼胶的饱和氯化钾溶液
C 盐桥中的阴离子向负极区移动
D 可以用导线代替盐桥
(3)写出图1中正极反应方程式_____________________
写出图2中的总反应方程式_____________________
(4)反应一段时间后,__________(填“图1”、 “图2”)中的Co电极质量增加。
(I)某同学设计实验探究构成原电池的条件,装置如下:
实验一:实验探究电极的构成〈甲图〉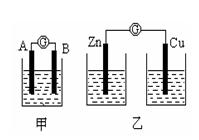
①A、B 两极均选用石墨作电极,发现电流计指针不偏转;② A、B 两极均选用铜片作电极,发现电流计指针不偏转;③ A极用锌片,B极用铜片,发现电流计指针向左偏转;④ A极用锌片,B极用石墨,发现电流计指针向左偏转。 结论一:____________________________________。
结论一:____________________________________。
实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
结论二 :____________________________________。
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
结论三:____________________________________。
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(1)在甲图装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向_______偏转。
(2)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。
(II)依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。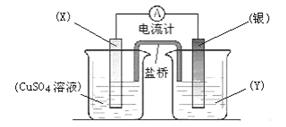
请回答下列问题:(1)电极X的材料是_________;电解质溶液Y是_________;
(2)当电路中转移0.01mol电子时,两电极的质量差为 g。
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
(2)镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的稀硫酸),电池总反应为:Mg+H2O2+H2SO4= MgSO4 +2H2O。该电池工作时,正极发生的电极反应式为: 。此时,正极周围海水的pH: (填:增大、减小或不变)
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O
 Al(OH)4-+ H+ ②NH3+H2O
Al(OH)4-+ H+ ②NH3+H2O NH4+ + OH-
NH4+ + OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式 。
(B)已知N2H4是二元弱碱,试写出其第二步电离方程式 。
某高二化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果如下:试根据上表中的实验现象回答下列问题:
| 编号 |
电极材料 |
电解质 溶液 |
电流计指针偏转方向 |
| 1 |
Mg、Al |
稀盐酸 |
偏向Al |
| 2 |
Al、Cu |
稀盐酸 |
偏向Cu |
| 3 |
Al、石墨 |
稀盐酸 |
偏向石墨 |
| 4 |
Mg、Al |
NaOH |
偏向Mg |
| 5 |
Al、Zn |
浓硝酸 |
偏向Al |
⑴实验1、2中 Al所作的电极是否相同?
⑵写出实验3中的电极反应式和电池总反应方程式。
⑶实验4中 Al做正极还是做负极,为什么?写出Al电极的电极反应式。
⑷解释实验5中电流计指针偏向Al的原因?
⑸根据实验结果总结:在原电池中金属铝作正极还是作负极受到哪些因素的影响。
试题篮
()