(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。

②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。

①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
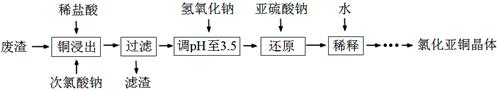
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ.[CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ.CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下:
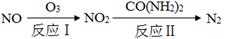
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
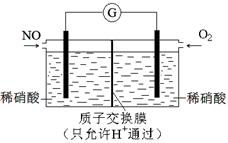
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。
化学电池在通讯、交通及日常生活中有着广泛的应用。
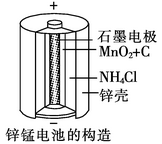
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负 极材料是 ,负极发生的电极反应方程式为: 。若反应消耗16.25 g 负极材料,则电池中转移电子的物质的量为 mol。
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O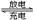 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(3)下图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的______(填“正”或“负”)极,Y极的电极反应方程式为 。
【改编】研究NO2 、SO2 、CO等大气污染气体的处理具有重要意义,完成下列问题:
I.已知:2SO2(g) + O2(g) 2SO3(g) ΔH1= —196.6 kJ·mol―1
2SO3(g) ΔH1= —196.6 kJ·mol―1
2NO(g) + O2(g) 2NO2(g) ΔH2= —113.0 kJ·mol―1
2NO2(g) ΔH2= —113.0 kJ·mol―1
(1)反应NO2(g) + SO2(g) SO3(g) + NO(g) 的ΔH= 。
SO3(g) + NO(g) 的ΔH= 。
(2)硫酸工业尾气中的SO2可利用氨水吸收,写出该反应的方程式____________________。
II.汽车尾气是城市空气污染的一个重要因素,常用以下反应净化汽车尾气:
2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
| 时间(s) |
0 |
2 |
4 |
6 |
8 |
10 |
| n(NO)(mol) |
0.4 |
0.32 |
0.26 |
0.22 |
0.20 |
0.20 |
(3)反应在4s内的平均速率为v(CO)= mol·L-1·s-1
(4)上述反应达到平衡后,继续加入NO 、CO、CO2各0.2mol和N2 mol时,平衡不移动。
(5)在上述条件下该反应能够自发进行,如果把温度从T1℃升高到T2℃,平衡常数K将 (填写“变大”、“变小”、“不变”)。
III.一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中的固体电解质是Y2O3-Na2O,O2ˉ可以在其中自由移动,
(6)O2ˉ移向电池 极(填“正”或“负”),
(7)负极的反应式为 。
【改编】SO2、NOx、CO2是对环境影响较大的气体,控制和治理SO2、NOx、CO2是减少酸雨、光化学烟雾和解决温室效应的有效途径。
(1)碳元素在元素周期表的位置: 。
(2)标况下2.24LSO2恰好被1L 0.2mol·L-1的NaOH溶液完全吸收,请写出吸收后溶液中离子浓度由大到小的顺序为 。
(3)已知汽车尾气NO与CO净化反应生成无污染气体,3g NO参加该反应放出37.99 kJ热量,请写出该反应的热化学方程式: 。
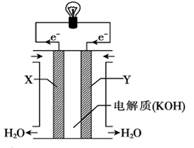
(4)某科研小组想以如图所示装置用原电池将 SO2转化为重要的化工原料。
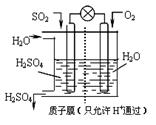
①其负极反应式: ,
②当有1mol SO2被吸收,则通过质子(H+)交换膜的H+离子数为 。
(5)某科研小组用CO2通过下面反应方程式来生产甲醇,
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1
现将6molCO2和8molH2充入一容积为2L的恒温密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。
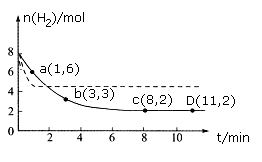
回答下列问题:
①此温度下该反应的平衡常数的数值K= 。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线改变的条件可能是 。
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ∆H1
CO(g)+H2O(g)===CO2(g)+H2(g) ∆H2
2CO(g)+O2(g)===2CO2(g) ∆H3
则CO2(g)+CH4(g)===2CO(g)+2H2(g)的∆H= 。
(2)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:
CO2(g)+CH4(g)  2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①该反应的平衡常数表达式为 。
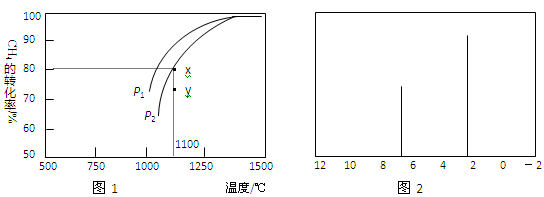
②在密闭容器中通入物质的量浓度均为0.1 mol•L—1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图l所示。则压强P1 P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正) v (逆)(填“大于"、“小于”或“等于")。
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如图2所示,则X的结构简式为 。
(5)科学家用氮化镓材料与铜组装如右图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
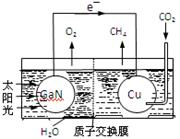
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。海水中的“水”电池总反应可表示为:5MnO2 + 2Ag + 2NaCl=Na2Mn5O10 + 2AgCl
(1)写出负极电极反应式 。
(2)当生1 mol Na2Mn5O10时,转移电子的数目是 。
用上述电池电解尿素[CO(NH2)2]的碱性溶液制合成氨的装置如图(隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

(3)写出A电极的名称 。
(4)写出电解时阳极的电极反应式 。
(5)已知电解排出液中n(OH-)/n(CO32-) =1,则起始时进入电解池中的原料配比n(KOH)/n[CO(NH2)2]是 。
将纯锌片和纯铜片按下图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法中正确的是__________(填序号)。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中H+的浓度均减小 |
(2)在相同时间内,两烧杯中产生气泡的速率:甲____乙(填“>”、“<”或“=”)。
(3)当甲中产生1.12 L(标准状况)气体时,理论上通过导线的电子数目为__________。
(4)当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1。试确定原稀硫酸的物质的量浓度为______________。
化学反应与能量密不可分,回答下列问题。
(1)已知31g白磷变为31g红磷时释放能量。试回答:
①上述变化属于____化学(填“物理”或“化学”)变化。
②31g白磷的能量_____(“>”或“<”)31g红磷的能量。
(2)A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸: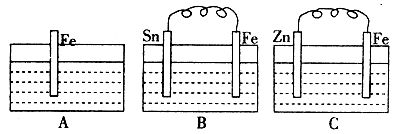
①分别写出B、C装置中铁片表面发生反应的电极反应式:
B______________________,C____________________。
②一段时间后,C中产生3.36L(标准状况下)气体时,硫酸恰好消耗完。此时,三个烧杯中液体质量由大到小的顺序为________(填字母),稀硫酸的物质的量浓度为________mol/L。
工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| |
不同时间各物质的物质的量/mol |
|||
| 0 min |
2min |
4min |
6min |
|
| CH4 |
2.00 |
1.76 |
1.60 |
n2 |
| H2 |
0.00 |
0.72 |
n1 |
1.20 |
根据表中数据计算:
①0 min~2min内H2的平均反应速率为 。
②达平衡时,CH4的转化率为 。在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比 (填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______。(填字母)
a.CO的含量保持不变
b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变
d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。
①a电极的名称为 。
②写出除去甲醇的离子方程式 。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为 。
某学生利用下图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。按照实验步骤依次回答下列问题: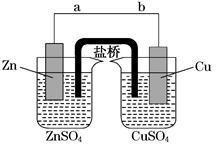
(1)导线中电子流向为____________(用a、b表示)。
(2)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________ (用“NA”表示);
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
(4)若将反应2Fe3++Cu===Cu2++2Fe2+设计成原电池,写出电极反应式。
正极反应______________;
(5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
①电池总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag:__________。
②2C2H2+5O2 4CO2+2H2O:_________________。
4CO2+2H2O:_________________。
③6H2O+6CO2 C6H12O6(葡萄糖)+6O2:__________。
C6H12O6(葡萄糖)+6O2:__________。
研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固定
新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K ①
已知:N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1 K1 ②
2H2(g) +O2(g) =2H2O(l) △H2=-571.6kJ·mol-1 K2 ③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 |
第一组 |
第二组 |
第三组 |
第四组 |
| t/℃ |
30 |
40 |
50 |
80 |
| NH3生成量/(10﹣6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
下列能说明反应①达到平衡状态的是_____(填字母)。
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是_________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下:
则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。
常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
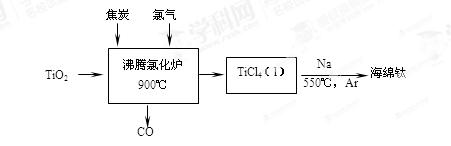
(1)TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
②Cl2含量检测仪工作原理如下图8,则Cl2在Pt电极放电的电极反应式为 。

③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为 mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K= 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如上图9所示,下列判断正确的是 (填序号)。
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察上图10回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(15分)
I.从海水中可以提取氯、溴、碘等卤族元素。
(1)碘元素在周期表中的位置为_________________________。
(2)已知:X2(g)+H2(g)  2HX(g)(X2表示C12、Br2和12)。下图表示平定衡常数K与温度t的关系。
2HX(g)(X2表示C12、Br2和12)。下图表示平定衡常数K与温度t的关系。
①△H表示X2与H2反应的焓变,△H_______O。(填“>"、“<’’或‘‘=’’)
②曲线a表示的是________(填“C12”、“Br2"或“12’’)与H2反应时K与t的关系。
II.C12是一种重要的化工原料。
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |
 |
| 储运要求 |
远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHS03溶液吸收 |
| 包装 |
钢瓶 |
①用离子方程式表示“泄漏处理’’中NaHS03溶液的作用__________________。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是__________________。
③氯气含量检测仪工作原理示意图如下:C12在Pt电极放电的电极反应式是_______________。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0.4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:
(已知:P205+3H20=2H3P04;C12与P205不反应。)
检测液氯的含水量,根据上图,需要测定的数据是_______________________________。
试题篮
()