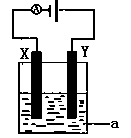
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出。符合这一情况的是附表中的

| |
a极板 |
b极板 |
X电极 |
Z溶液 |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
用惰性电极电解足量下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是
| A.CuCl2 [CuCl2溶液] | B.NaOH [NaOH溶液] |
| C.NaCl [HCl气体] | D.CuSO4 [Cu(OH)2] |
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
1 L 0.1 mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16 g时,下列判断中正确的是
| A.AgNO3溶液的浓度减小 |
| B.阳极上产生O2 |
| C.转移的电子数为0.02NA个 |
| D.阴极发生了氧化反应 |
在固态金属氧化物电解池中,高温并电解H2O-CO2混合气体(1:1)制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是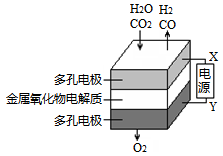
| A.X是电源的负极 |
| B.阴极的反应式是:H2O+2e-==H2+O2-;CO2+2e-==CO+O2- |
C.总反应可表示为:H2O+CO2 H2+CO+O2 H2+CO+O2 |
| D.阴、阳两极生成的气体的物质的量之比是1:1 |
电解NO制备NH4NO3,其工作原理如右图所示,下列说法不正确的是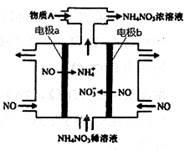
| A.b极的电极反应为:NO-3e-+4OH-=NO3-+2H2O |
| B.溶液中的H+由电极b处向电极a处迁移 |
| C.电解过程总反应的化学方程式为: 8NO+7H2O 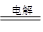 3NH4NO3+2HNO3 3NH4NO3+2HNO3 |
| D.为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
| A.b是阳离子交换膜,允许Na+通过 |
| B.从A口出来的是NaOH溶液 |
| C.阴极反应式为4OH--4e-= 2H2O+O2↑ |
| D.Na2SO4溶液从G口加入 |
(1)已知H-H 键能为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式: N2(g)+3 H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s) + H2O(g) =" CO(g)" + H2(g) △H > 0
B.2H2(g)+O2(g)=2H2O(1) △H < 0
C.NaOH(aq) + HC1(aq) =" NaC1(aq)" + H2O(1) △H < 0
(3)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式___________。
(4)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
③若用此电解装置模拟工业精炼铜,则应将a改为 溶液,并将 极换成粗铜(填“X”或“Y”)
碘盐中添加的碘酸钾在工业上可用电解KI溶液制取,电极材料是石墨和不锈钢,化学方程式是:KI+3H2O KIO3+3H2↑,有关说法不正确的是
KIO3+3H2↑,有关说法不正确的是
| A.石墨作阳极,不锈钢作阴极 |
| B.I-在阳极放电,H+在阴极放电 |
| C.电解过程中电解质溶液的pH变小 |
| D.电解转移3 mol e-时,理论上可制得KIO3 107 g |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.当电池负极消耗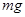 气体时,电解池阴极有 气体时,电解池阴极有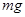 气体生成 气体生成 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
C.电解后,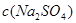 不变,且溶液中有晶体析出 不变,且溶液中有晶体析出 |
D.电池中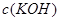 不变;电解池中溶液 不变;电解池中溶液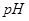 变大 变大 |
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将_______。(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1 000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2___________T1。
(2)下图所示装置可用于制备N2O5,则N2O5在电解池的_________区生成,其电极反应式为_________________。
某同学设计了一种电解法制取Fe(OH)2的实验装置(如右图)。玻璃管内的电解液为NaCl溶液, 通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:

(1)写出A电极的电极反应式 ;B电极的电极反应式 ;
(2)若电解改用NaOH溶液作电解液,发现电解一开始即出现灰绿色沉淀,该沉淀产生在 极附近(选填“A”或“B”)。试分析为什么用NaCl溶液作电解液时白色沉淀能保持较长时间的原因: 。
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气(氯气有毒,可以用NaOH溶液吸收,氯气可以和碘化钾反应生成碘单质)。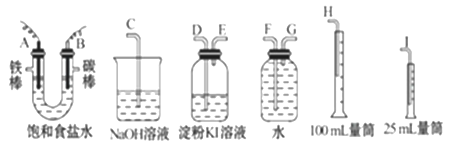
(1)A极发生的电极反应式是___________________,
B极发生的电极反应式是_______________________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接______、 ______接______ ; B接______ 、 ______接______ 。
(3)证明产物中有Cl2的实验现象是_________。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为________。
试题篮
()