一些科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学合成氨的有关叙述正确的是
| A.N2在阴极上被氧化 |
| B.可选用铁作为阳极材料 |
| C.阳极的电极反应式是N2+6e-+6H+ = 2NH3 |
D.该过程的总反应式是N2+3H2 2NH3 2NH3 |
下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是
| A.在①中溶液的Cu2+向铜棒移动 |
| B.电极上析出物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
如图所示,A、B是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
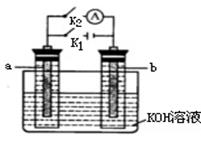
A.断开K2,闭合K1时,A极上的电极反应式为:4OH¯一4e¯=== O2↑十+2H2O
B.断开K2,闭合K1一段时间,溶液的pH要变大
C.断开K1,闭合K2时,B极上的电极反应式为: 2H++2e¯=== H2↑
D.断开K1,闭合K2时,OH¯向B极移动
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2=4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
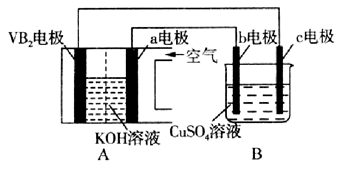
| A.电解过程中,c电极表面先有红色物质析出,然后有气泡产生 |
| B.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e-=V2O5 + 2B2O3 + 22H+ |
| C.外电路中电子由c电极流向VB2电极 |
| D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
在电冶铝的电解槽中存在电解质W3XZ6—XZ3—X2Y3,己知X、Y、Z、W四种元素的简单离子的电子层结构均相同。X原子最外层电子数等于电子层数,则下列说法正确的是
| A.原予序数:W>X>Y>Z |
| B.原子半径:r(W)>r(X)>r(Y)>r(Z) |
| C.最高价氧化物对应的水化物碱性:W<X |
| D.在电解过程中,W3XZ6的主要作用是增强电解质的导电性 |
下列叙述中,正确的是
①电解池是将化学能转变成电能的装置
②金属和石墨导电均为物理变化,电解质溶液导电是化学变化
③不能自发进行的氧化还原反应,通过电解的原理有可能实现
④将铜锌原电池用含KCl的盐桥相连时,盐桥中的Cl-会移向正极区
⑤利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加直流电的阴极保护法
| A.①②③④ | B.④ | C.①④⑤ | D.②③⑤ |
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
| 物质 |
氯化铜 |
氧化亚铜 |
氢氧化亚铜(不稳定) |
氯化亚铜 |
| 颜色 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
红色 |
橙黄色 |
白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e¯ ═ H2↑+ 2OH¯
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
用石墨作电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Cu2+ 的物质的量浓度为
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.电解后溶液中c(H+)为2 mol/L |
| B.上述电解过程中共转移2 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.原混合溶液中c(K+)为2 mol/L |
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,如果向所得的溶液中加入0.1molCu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为( )

| A.0.2mol | B.0.4mol | C. 0.6mol | D.0.8mol |
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
| A.燃料电池的总反应为:2Al+3HO2- = 2AlO2-+ 2H2O |
| B.电解时,Al消耗2.7g,则产生氮气的体积为1.12L |
| C.电极b是负极,且反应后该电极区pH增大 |
| D.电解过程中,电子的流向由a→d,c→b。 |
电浮选凝聚法是工业上采用的一种污水处理方法:在污水中通电生成Fe(OH)3胶体,Fe(OH)3胶体可吸附污染物而沉积下来,具有凝聚净化的作用:电极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去浮渣层,即起到了浮选净化的作用。某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法不正确的是
| A.装置A中铁片为阳极,发生的电极反应是Fe-2e- = Fe2+ |
| B.装置B中通入空气的电极反应是O2+2CO2+4e- = 2CO32— |
| C.污水中加入适量的硫酸钠,可增强溶液的导电性,提高污水的处理效果 |
| D.标准状况下,若A装置中产生了44.8L气体,则理论上B装置中要消耗CH4为1.12L |
以石墨电极电解200 mL CuSO4溶液,电解过程中转移电子的物质的量n(e—)与产生气体体积V(g)(标准状况)的关系如下图所示。下列说法中,正确的是
| A.电解前CuSO4溶液的物质的量浓度为2 mol/L |
| B.电解后所得溶液中c(H+)=2 mol/L |
| C.当n(e—)=0.6 mol时,V(H2)∶V(O2)=2∶3 |
| D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
试题篮
()