在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
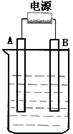
(1)A接的是电源的 极,B是该装置 极,B电极反应式为 。
(2)写出电解时反应的总离子方程式 。
(3)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 。(假设电解前后溶液的体积不变)
(4)MnO2可作超级电容器材料。用惰性电极电解酸性MnSO4溶液可制得MnO2,其阳极的电极反应式是____________________
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

如下图为相互串联的甲、乙两电解池。试回答:
(1)若甲电解池利用电解原理在铁上镀银,则B是(填电极材料),电极反应为,甲中电解质溶液的溶质为__________。
(2)若甲电解池某极增重4.32g,则乙槽中Fe极上放出的气体在标准状况下的体积是__________mL。
(3)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于__________。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴
石蕊试液,则
①电解池中X极上的电极反应式为 ,
②Y电极上的电极反应式为 ,在Y极附近观察到的现象是 。
③电解总反应方程式为 。
(2)如X是金属铁,要在铁件的表面镀铜防止铁被腐蚀,则
①Y电极的材料是 ,电极反应式是 。电解液a选用  溶液。电解过程中其浓度 (增大、减小或不变)
溶液。电解过程中其浓度 (增大、减小或不变)
②若电镀前X、Y两电极的质量相同,电 镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为_______mol。
镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为_______mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
下图中p、q为直流电源两极,A极由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:
(1)p为_____极,A极发生了______反应。
(2)C极的电极反应方程式为:______________________;
(3)在电解过程中,测得了C、D两极上产生的气体的实验数据如下:仔细分析以上实验数据,请说出可能的原因是______ 。
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 阴极气体体积(cm3) |
6 |
12 |
20 |
29 |
32 |
42 |
52 |
62 |
72 |
82 |
| 阳极气体的体积(cm3) |
2 |
4 |
7 |
11 |
16 |
2l |
26 |
3l |
36 |
41 |
(4)电解一段时间后,若将硫酸溶液浓度恢复到电解前,应加入的物质是_____
(5)当电路中通过0.004 mol 电子时,B电极上沉积金属 X的质量为0.128g,则此金属的摩尔质量为_______。
若A电极改用石墨电极电解400mLXSO4溶液,则此时溶液pH为 。
氯碱工业中电解饱和食盐水的原理示意图如图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
检验阳极反应产物的方法是:______________________________________________________
___________________________________________________________________________________
(11分)电解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)X的电极名称是 。
(2)若X、Y都是惰性电极,a是硫酸钠溶液,实验开始时,同时在两边各滴入几滴石蕊试剂,一段时间后,在X极附近观察到的现象是 ,Y极上的电极反应式为 。
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出金属的质量为 g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是
,Y电极的材料是 。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是 。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |
将500mL0.1mol/L的CuSO4溶液和500mL4mol/L的NaCl溶液相混合,然后用石墨电极进行电解,电解过程中共有0.4mol电子通过。试计算:
(1)阴极上可析出铜 克。
(2)在标准状况下阳极上可以产生 毫升气体。
(3)假设电解过程中溶液体积的变化忽略不计,则当有0.2 mol电子通过时,溶液的PH为 。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42—、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。

接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)写出乙烧杯的电解池反应
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。
(1998年上海)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以
是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为 (选填a、b、c多选扣分)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
如图,将铜片和锌片焊接在一起组成A电极,B为碳棒进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1)请写出A.B两极发生反应的电极反应式A: B:
(2)请分析A.B两极质量变化情况为A:___________B:__________
(11分)设计燃料电池使汽油氧化直接产生电流,是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷(C8H18)为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- =8CO2 + 9H2O +50e-,,正极的电极反应式为 ,固体电解质里O2-的移动方向是 。
(3)用此电池分别电解以下两种溶液,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了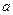 g M,则金属M的相对原子质量
g M,则金属M的相对原子质量
(用含“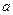 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是 ;将电解后的溶液加水稀释至1L,此时溶液的c(H+)= 。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
⑴现将0.04mol·L-1的HA溶液与0.02mol·L-1的NaOH溶液等体积混合。如HA是HCN,溶液中c(Na+)>c(CN-),则该混合溶液c(H+) ▲ c(OH-)(请填“>”“<”或“=”),c(HCN)+c(CN-)= ▲ mol·L-1。如HA是CH3COOH,该混合溶液呈酸性,c(CH3COOH) ▲ c(CH3COO-)(请填“>”、“<”或“=”)。
⑵常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。回答下列问题:
①在同一溶液中,H2CO3、HCO3-、 CO32- ▲ (填:“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: ▲ 。
⑶已知在25℃时,CO32-水解反应的平衡常数即水解常数
Kh==2×10-4,当溶c(HCO3-)︰c(CO32-)=20︰1时,溶液的pH=_▲_。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积_____________。
(3)写出乙烧杯的电解池总反应_____________________________。
(4)若电解后甲溶液的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入 g 。(填写化学式)
试题篮
()