(6分)试回答下列问题(温度均为25℃时):
(1)将0. 2mol / L HB溶液与0.1 mol / LMOH溶液等体积混合,测得混合溶液的pH=4,则混合溶液中由水电离出的c(H+)__ __0. 2 mol / L HB溶液中由水电离出的c(H+)。(填“>”、“<”或“="”" )
(2)pH=13的Ba(OH)2溶液a L与pH=3的HCl溶液b L混合。若所得混合溶液呈中性,
则a∶b= ;
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为________________________________。
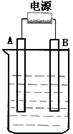
(1998年上海)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以
是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为 (选填a、b、c多选扣分)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。

如图是一个用铂丝作电极,电解稀的溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的
变色范围:6.8~8.0,酸色-红色,减色-黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是(填编号);
①管溶液由红变黄;②
管溶液由红变黄;
③管溶液不变色;④
管溶液不变色;
(2)写出管中发生反应的反应式:;
(3)写出管中发生反应的反应式:;
(4)检验管中气体的方法是;
(5)检验管中气体的方法是;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是。
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

如下图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
(1)打开K2,合并K1.B为 极,A的电极反应为 ,最终可观察到的现象是 .
(2)打开K1,合并K2.E为 极,F极的电极反应为 ,
检验F极产生气体的方法是 .
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 ,原因是 .
(11分)设计燃料电池使汽油氧化直接产生电流,是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷(C8H18)为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- =8CO2 + 9H2O +50e-,,正极的电极反应式为 ,固体电解质里O2-的移动方向是 。
(3)用此电池分别电解以下两种溶液,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了 g M,则金属M的相对原子质量
g M,则金属M的相对原子质量
(用含“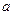 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是 ;将电解后的溶液加水稀释至1L,此时溶液的c(H+)= 。
(9分)在右图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极。接通电路后,发现B上的c点显红色。试回答:
(1)电源A上的b为__________极。
(2)写出B上的电极反应式:
c_______________________;d_______________________。
(3)e、f电极上所产生的气体分别为__________、__________,其体积比为__________。
氯碱工业中电解饱和食盐水的原理示意图如图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
检验阳极反应产物的方法是:______________________________________________________
___________________________________________________________________________________
现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题。
(1)写出氯碱工业中电解饱和食盐水的反应式________________,阳离子交换膜在氯碱工业中的作用是____________________________________________。写出用惰性电极电解硫酸钠水溶液的总反应式:____________________________________________。
(2)请利用交换膜技术,根据上图框架,设计一个电解硫酸钠溶液制氢氧化钠溶液和硫酸溶液的装置,标出进出物质的名称。A___________;B___________;C___________;D___________;E___________;F___________;G___________。膜b为___________(填“阳离子交换膜”或“阴离子交换膜”)。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积_____________。
(3)写出乙烧杯的电解池总反应_____________________________。
(4)若电解后甲溶液的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入 g 。(填写化学式)
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
(1)A接的是电源的 极,B是该装置 极,B电极反应式为 。
(2)写出电解时反应的总离子方程式 。
(3)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 。(假设电解前后溶液的体积不变)
(4)MnO2可作超级电容器材料。用惰性电极电解酸性MnSO4溶液可制得MnO2,其阳极的电极反应式是____________________
如下图为相互串联的甲、乙两电解池。试回答:
(1)若甲电解池利用电解原理在铁上镀银,则B是(填电极材料),电极反应为,甲中电解质溶液的溶质为__________。
(2)若甲电解池某极增重4.32g,则乙槽中Fe极上放出的气体在标准状况下的体积是__________mL。
(3)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于__________。
(11分)电解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)X的电极名称是 。
(2)若X、Y都是惰性电极,a是硫酸钠溶液,实验开始时,同时在两边各滴入几滴石蕊试剂,一段时间后,在X极附近观察到的现象是 ,Y极上的电极反应式为 。
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出金属的质量为 g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是
,Y电极的材料是 。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是 。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________.
(2)铝与氢氧化钾溶液反应的离子方程式是 .
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
①该电解槽的阳极反应式是___________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因__________ .
③除去杂质后的氢氧化钾溶液从出口______(填写“A”或“B”)导出。
试题篮
()