电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连。
(1)若X是锌,Y是碳棒电极,a是饱和NaCI溶液,则①该原理可制得化工原料有 ;②Y极的电极反应式为
(2)若要用电解方法精炼粗铜,则①电解液a选用 ;②Y电极反应式是 。(说明:杂质发生的电极反应不必写出)
(3)若要在某铁制小饰品上镀上一层银,则①Y电极的材料是 ;②X电极反应式是 。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋 资源。试回答下列问题:
资源。试回答下列问题:
(1)海水中含有大量的氯化钠。氯化钠中的金属元素化合价为 ;除去NaCl溶液中的SO42-,可依次加入 、 和 三种溶液。
和 三种溶液。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是 将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填“物理变化”、
将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填“物理变化”、 “化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
“化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t 。
NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t 。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:
写出反应②③的化学反应方程式: , 。
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为_______ B池为______
(2)锌极为______极,电极反应式为______________
铜极为______极,电极反应式为______________
石墨棒C1为_____极,电极反应式为__________
石墨棒C2为_____极,附近发生的实验现象为_____________
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化(增加或减少)____、_____g,CuSO4溶液的质量变化了(增加或减少了)_____、____g
下表是某食用碘盐包装袋上的部分说明:
| 配 料 |
食盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极电极反应式为
KIO3 + 3H2↑。则阳极电极反应式为
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,标出电子转移方向和数目。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
该反应的氧化剂为
(4)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和CuSO4溶液,实验开始时,同时在两边各滴入石蕊试液,则①Y电极上的电极反应式为
②在Y电极附近观察到的现象是
(2)若X、Y都是铜电极,a是浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后X电极上有12.8g铜析出,此时直流电源已输出 mol电子。
(3)用石墨电极电解100mLH2SO4和CuSO4混合液,通电一段时间后,两极各出现气体3.36L(标准状况),求原来溶液中CuSO4的浓度 。
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______________________________。
②甲池中石墨电极上的电极反应属于______(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,反应的化学方程式为__________________________________。
④若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=_______。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电源的N端为 极;
(2)写出电解前后各溶液的pH变化情况(增大、减小或不变 ):
):
甲溶液 ;乙溶液 ;丙溶液 ;
(3)电极b上生成的气体在标准状态下的体积是 ;
电极c的质量变化是 g。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 5.00%的NaOH溶液、足量的CuSO4溶液和l00
5.00%的NaOH溶液、足量的CuSO4溶液和l00 10.00%的K2SO4溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
10.00%的K2SO4溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:

①电源的N端为 极;
②电极b上发生的电极反应为 ;
③电极b上生成的气体在标准状况下的体积: ;﹙精确到小数点后一位小数﹚
④电极c的质量变化是增加  ;
;
(共6分,每空2分).从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________________________;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是________________________________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_________________________________。
在右下图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g。
请回答下列问题:
(1)B电极发生反应的电极反应式 。
C电极发生反应的电极反应式 .
(2)甲池电解时反应的离子方程式 。
(3)甲池电解后溶液的c(H+)为 ,要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 g。(假设电解前后溶液的体积不变)
(4)请你设计实验确定甲池原溶液中可能含有的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤、实验现象和实验结论
①假设一: ; ②假设二: 。
②假设二: 。
(5)若再将K1断开,闭合K2,灵敏电流计 中指针是否会发生偏转?理由是什么?
雾霾含有大量的污染物SO2、NO。工业上变废为宝利用工业尾气获得NH4NO3产品的流程图如下:(Ce为铈元素)

(1)上述流程中循环使用的物质有 。
(2)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2 + H2O HOCH2CH2NH3+ + OH-,写出乙醇胺吸收CO2的化学方程式__________。
HOCH2CH2NH3+ + OH-,写出乙醇胺吸收CO2的化学方程式__________。
(3)写出吸收池Ⅲ中,酸性条件下NO转化为NO2-的离子方程式为 。
(4)向吸收池Ⅳ得到的HSO3﹣溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: 。
(5)电解池Ⅴ可使Ce4+再生,装置如下图所示:

生成Ce4+从__________口(填字母)流出,写出阴极的电极反应式 :
(6)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是 、 、过滤、洗涤等。上述流程中每一步均恰好完全反应,若制得NH4NO3质量为xkg,电解池V制得cmol/L的S2O32﹣溶液ym3,则氧化池Ⅵ中消耗的O2在标准状况下的体积为 m3。
氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答氯碱工业的如下问题:
(1)原料粗盐中常含有泥沙和Ca2+、Mg2+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是___________(填序号)
(2)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系示意图如下(其中的电极均为惰性电极,物料进出口未全部标出)。

①图中A是 (填化学式),分析比较图示中两处氢氧化钠质量分数x%______y%
(填“>”或“<”或“=”)。
②写出燃料电池中正极上发生的电极反应: 。
③标准状态下,当燃料电池消耗22.4LO2时,通过电池中阳离子交换膜的阳离子的物质的量为 mol。
④这样设计的主要节(电)能之处在于 。
空气污染监测仪是根据SO 2 与Br 2 的定量反应测定空气中SO 2 的含量:SO 2 +Br 2 + 2H 2 O="=H" 2 SO 4 +2HBr,上述反应的溴,来自一个装满酸性KBr溶液的电解槽阳极上的氧化反应。电解槽的阴、阳极室是隔开的。当测空气中SO 2 的含量时,空气(经过除尘)以1.5×10 - 4 m 3·min - 1 的流速进入电解槽的阳极室,电流计显示每秒通过的电子是8.56×10 - 1 1mol时,此条件下能保持溴浓度恒定,并恰与SO 2 完全反应(设被测空气中不含与溴反应的物质)。
(1)写出监测过程中主要发生的化学反应方程式;_______________________。
(2)计算空气中SO 2 的含量(g·m - 3 空气)。
按要求书写下列热化学方程式
(1)N2(g)和H2(g)反应生成1molNH3(g)放出46.1KJ热量
(2)航天领域使用氢氧燃烧电池有酸式和碱式两种,它们放电时的总反应可以表示为2H2 + O2 =2H2O,酸式氢氧燃烧电池的电解池是酸。其负极反应可以表示为2H2-4e-=4H+,则其正极反应可以表示为; ;碱式氢氧燃烧电池的电解质是碱,其正极反应可以表示为:O2+2H2O+4e-=4OH-,则其负极反应可以表示为: 。
(3)用石墨作电极电解NaCl水溶液
阳极的电极反应 ,阴极的电极反应
(4)在粗铜精炼的反应中
当阳极,发生 (填“氧化”或“还原”)反应,
阳极的电极反应
(5)将H+、Cu2+、SO42-、Cl-五种离子组成电解质按要求进行电解:以碳棒为电极,使电解质质量减少,水量不变进行电解,应采用的电解质是 、 ;
(1)甲烷是一重要的清洁能源、请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式: 。
(2)电解原理在化学工业中有广泛的应用。图中a为电解液,X和Y是两块电极板,则:
①若X和Y分别为铁和石墨,a为饱和食盐水,则电解时X电极反应式为 。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
(3)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。电解完毕后,某兴趣小组欲对电解溶中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如下图。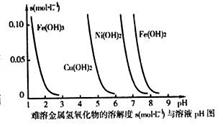
①结合右图分析,相同温度下Kap[Cu(OH)2]、Kap[Ni(OH)2]、Kap[Fe(OH)2]由大到小的顺序为 。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+、Fe2+和Ni2+沉淀的先后顺序依次为 (填写离子符号)。
试题篮
()