黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS )进行如下实验探究。
)进行如下实验探究。
[实验一]:测定硫元素的含量
I.将m g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有________________________、________________________________。
(2)Ⅱ中。所加H O
O 溶液需足量的理由是________________。
溶液需足量的理由是________________。
(3)该黄铁矿石中硫元素的质量分数为________________。
[实验二]:设计以下实验方案测定铁元素的含量
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?________。若不合理,会如何影响测量结果:________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(6)④中高锰酸钾溶液应放在_____滴定管中;判断滴定终点的现象为________________。
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。
(1)用下图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当
时(填实验现象),说明“铁与水蒸气”能够进行反应。
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称取一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率。
①收集并测量气体体积应选右图中的________装置(填A或B)。
②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088g/L,最好选用 规格的量筒(选填字母序号)
A.100mL B.200mL C.500mL D.1000mL
③收集的气体体积为VL,铁粉的转化率为 。
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解、过滤。向滤液中滴加KSCN溶液,观察溶液的颜色。在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满)。
| |
现象 |
结论与解释 |
| 可能① |
|
|
| 可能② |
|
|
某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定NO的体积:
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
3→ (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如右图所示。请将读数填到表格的相应位置:
| |
滴定前读读数/mL |
滴定后读数/mL |
| 第一次 |
|
|
| 第二次 |
0.10 |
18.00 |
| 第三次 |
0.20 |
18.30 |
依据表格的数据计算出在B容器中生成硝酸的物质的量为 mol。
(3)气体成份分析:
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中
(填“有”或“没有”)NO产生,作此判断的依据是 。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一 红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
I.设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN 试剂。
(1)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体 ,写出发生反应的离子方程式:
II.探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(2)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
4.7 |
5.5 |
2.4 |
| 沉淀完全pH |
6.7 |
9.4 |
3.7 |
设计实验方案:
可供选择试剂:
| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |
试回答:①试剂1为 ,试剂2为 (填字母)。
②固体X的化学式为 。③操作I为 。
(3)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为 。
已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致,则使溶液呈黄色的微粒是:______ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,则使溶液呈黄色的微粒是_________;
(2)如果要验证乙同学判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 |
| D.硫氰化钾溶液 E.硝酸银溶液 F.碘化钾淀粉溶液 |
| 实验方案 |
所选用试剂(填代号) |
实验现象 |
| 方案一 |
|
|
| 方案二 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离子是______ ,相应的离子方程式为 ;
某研究性学习小组拟通过铜银合金与浓硝酸的反应,测定该合金的组成。考虑到NO2的聚合,该小组同学查阅到下列资料:
17℃、1.01×105Pa,2NO2(g) N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4和NO2的混合气体达到平衡时c(NO2)="0.0300" mol·L-1。
N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4和NO2的混合气体达到平衡时c(NO2)="0.0300" mol·L-1。
⑴此时平衡混合气体中c(N2O4)= (保留两位有效数字,下同)。
⑵17℃、1.01×105Pa时,将12.44g合金放入足量浓硝酸中,待合金完全溶解后,收集到NO2和N2O4的混合气体5.00L。
①根据平衡体系中NO2和N2O4的物质的量浓度,计算5.00L气体中NO2、N2O4的物质的量分别为 、 。
②计算合金中银的质量分数。
(J4分)
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)已知锰元素的常见化合价为+7、+6、+4、+2,写出圆底烧瓶中反应的化学方程式
。
(2)A中m管的作用是 ,装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与Mn0:混合加热生成氯气,稀盐酸与Mn0:混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.Mn02与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
某课外小组在实验室制备氨气,并进行有关氨气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。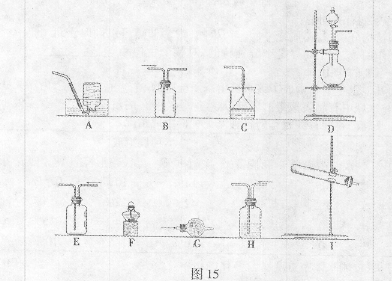
①应该选用的仪器及装置有(填字母) 。
②生石灰与氯化铵反应生成氨气的化学方程式为 。
(2)该小组同学设计如图16所示装置探究氨气的还原性。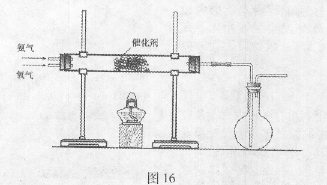
①氨催化氧化的化学方程式为 。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。再选择合适的方案并说明原因。
②检验产物中有NH4+的方法为 。
某班学生在老师指导下探究氮的化合物的某些性质。
(1)同学甲在实验室利用下列装置(后面有图)制取氨气和氧气的混合气体,并完成氨的催化氧化。
A中加入浓氨水,D中加入碱石灰,E内放置催化剂(铂石棉),请回答:
①仪器B的名称:__________。B内只需加 入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原
入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原 因(结合化学方程式回答)_ __。
因(结合化学方程式回答)_ __。
②按气流方向连接各仪器 (填接口字母)
(2)同学乙拟用甲同学得到的混合气体X(NO及过量的NH3),验证NO能被氨气还原并测算其转化率(忽略装置内空气的影响)。装置如下:
①装置C的作用可能是 ____________。
②若进入装置A的NO共268.8mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下190.4 mL N2,则NO的转化率为 。
(3)N2O3是一种新型硝化剂。一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3+O2 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O3)/mol·L-1 |
5.00 |
3.52 |
2.48 |
计算在t=500s时,NO2的反应速率为 。
(14分)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸
| A.1.0 mol·L-1HNO3 | B.1.0 mol·L-1盐酸 | C.1.0 mol·L-1 NaOH | D.3%H2O2(E)、 0.1mol·L-1KI(F)、 0.1 mol·L-1CuSO4(G)、 20%KSCN(H)、澄清石灰水(I)、氧化铜(J)、蒸馏水(K)。 |
(1)要验证产物中有CO2、CO存在的试剂________应选(按先后顺序把所选试剂的代号字母填入空格内。)
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中CO32-的方法是 。
(3)固体产物中铁元素存在形式的探究。
固体产物中铁元素存在形式的探究。
①提出合理假设;假设1:只有Fe;假设2:只有FeO;假设3:FeO和Fe。
②设计实验方案证明假设
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。
步骤2:将步骤1中的不溶固体产物加入1.0mol·L-1盐酸中。
步骤3:将步骤1中的不溶固体产物加入足量的0.1 mol·L-1CuSO4中充分反应后过滤、洗涤后,将沉淀物溶于1.0 mol·L-1盐酸,再加入20%KSCN,最后加入3%H2O2。
③实验过程(填写下表的空格)
| 实验步骤 |
预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 |
固体产物部分溶解 |
| 步骤2:向试管中加入适量硫酸铜溶液,再加入少量将步骤1中的不溶固体,充分振荡 |
(1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设 成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体生成.则证明有 存在。 |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN |
结合步骤2中的(2): (1)若溶液基本无色,则假设(1)成立 (2)若 ,则假设 成立 |
某化学课外活动小组研究乙醇氧化的实验并验证其产物,并从“乙醇催化氧化实验”得到一些认识有关催化剂的催化机理等问题。
 (1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
(1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
请回答以下问题:
①被加热的铜丝处发生的反应的化学方程式为________。
②从A管中可观察到 实验现象。
(2)乙同学研究乙醇氧化的实验并验证其产物,组合一套实验装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
①若要保证此实验有较高的效率,还需补充的仪器有___________。
理由____________。
②实验中能验证乙醇氧化产物的实验现象是__________________________。
③装置中,若撤去高锰酸钾加热部分并用夹子夹K,其它操作不变,则无水硫酸铜无明显变化,其余现象与②相同,推断燃烧管中主要反应的化学方程式______________________________。
某化学课外活动小组进行了一系列“带火星的木条复燃”的实验,实验装置如下图。
(1)甲组同学探究“使带火星木条复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
回答问题:
①使带火星木条复燃的O2的体积分数最小(第IV组数据)约为____________。
②用带火星木条检验集气瓶里是否集满O2,若木条复燃,能否认为集气瓶里的气体一定是纯净的O2?答:__________(填“能”或“否”)。
③若按照3:2的比例混合O2和CO2气体,该混合气体能否使带火星的木条复燃?答:___________(填“能”“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 |
制取气体A(下列反应产生的混合气体) |
B中的现象 |
结论 |
| a |
在烧瓶中加热适量浓HNO3 |
充满红棕色气体,木条不复燃,火星熄灭 |
NO2不支持燃烧 |
| b |
加热AgNO3固体 |
充满红棕色气体,木条复燃 |
NO2支持燃烧 |
| c |
加热Cu(NO3)2固体 |
充满红棕色气体,木条复燃 |
NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?若不可靠,说明原因;若可靠,则不需说明。
a. ___________,原因是______________________________。
b. ___________,原因是______________________________。
c. ___________,原因是______________________________。
向溴水中加入足量乙醛溶液,可以观察到溴水褪色。对产生该现象的原因有如
下三种猜想:①溴水与乙醛发生了取代反应;②溴水与乙醛发生了加成反应③溴水将乙醛氧化成乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性
方案二:测定反应前溴水中Br2的物质的量和反应后Br-的物质的量
(1)方案一是否可行? ,理由
(2)假设方案二中测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=
mol,说明溴水与乙醛发生了取代反应;若测得反应后n(Br-)= mol,说明溴水与乙醛发生了加成反应;若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化成乙酸。
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。
①洗气瓶中浓硫酸的作用是 。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式 。
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);
①连接仪器。将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氧气,实验过程中能观察到的现象是 。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有 。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe3+可采用的试剂为 ;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为 mol。
(每空2分,共12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出 如下的问题,探究。请你协助该小组的同学完成下列研究。
如下的问题,探究。请你协助该小组的同学完成下列研究。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也 能被NH3还原吗?
能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、_________(填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为_____。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
实验中观察到CuO变为红色物质,无水CuSO4变____色。同时生成一种对大气无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是____________________________________。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是__________________________________。
【问题讨论】
(1)有同学认为NH3与CuO反应生成的 红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质
红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质 是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
试题篮
()