由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如下,下列说法正确的是
| A.纳米碳管是一种无机化合物 |
| B.纳米碳管中碳原子间以共价键结合 |
| C.纳米碳管与石墨互为同位素 |
| D.0.12g纳米碳管中含有6.02×l022个碳原子 |
硼.碳.氮.硅元素的单质及其化合物是构成自然界的重要物质。
(1)硼元素原子核外电子排布式_________________。氮元素原子的核外电子中,未成对电子数与成对电子数之比为 。
(2)甲烷是最简单的有机物,实验室可通讨下列反应制取: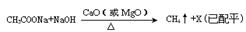 ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
(3)甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2 H2O → 8Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断非金属性Si比 H (填“强”.“弱”或“无法比较”)
(4)石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
碳与硅是十分重要的两种元素,金刚石、SiC具有耐磨、耐腐蚀特性,应用广泛。
(1)碳元素在周期表中的位置是_______________,其原子核外通常未成对电子数为___________个。
(2)已知2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)反应中,被破坏的化学键有________。
a.离子键 b.极性共价键 c. 非极性共价键
(3)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,除去粗产品中少量钠的试剂为_______________。
(4)下列叙述正确的有____________填序号),
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③NaSiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④Si在一定条件下可与FeO发生置换反应
C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气( )分子中含有______个
)分子中含有______个 键,____个
键,____个 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
(5)超硬材料氮化销的晶胞如图 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。
H、C、N、O、都属于自然界中常见非金属元素。
(1)O、C、N三种元素的第一电离能由小到大顺序是 ;NH4+中氮原子轨道的杂化类型为________。 (2)CO、N2的结构可表示为:
(2)CO、N2的结构可表示为:
两者的键能数据:(单位kJ/mol)
| |
A—B |
A=B |
 |
| CO |
357.7 |
798.9 |
1071.9 |
| N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因 。
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料。 该物质的化学式为: 。
金属铜的导电性仅次于银,大量用于电气工业。
(1)写出铜的基态原子价电子电子排布式________。
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学 式为__________。
(3)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2。晶体。氨分子中N原子的杂化方式为____________。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(4)NH3的沸点比PH3大,其原因是_________________________________.
卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。
(2)Br原子的核外电子排布式为_________。
(3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。
(4)CCl4分子中碳原子的杂化方式为________,NF3分子的空间构型为________。
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO_____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的 键有________mol。
键有________mol。
金属铜的导电性仅次于银,大量用于电气工业。
(1)写出铜的基态原子价电子电子排布式________。
(2)铜的某种氯化物晶体的晶胞结构如右图所示 ,该氯化物的化学式为__________。
,该氯化物的化学式为__________。
(3)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体。氨分子中N原子的杂化方式为__________。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(4)NH3的沸点比pH3大,其原因是________________________________。
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为﹣96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式为 。
(2)CH3COCH3分子中含有 个π键,含有 个δ键。
(3)固态氯化铬酰属于 晶体,丙酮中碳原子的杂化方式为 ,二硫化碳属于 (填极性”或“非极性”)分子。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有有 键。
(5)金属铬的晶胞如下图所示,一个晶胞中含有 个铬原子。
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
(1)E2+的核外电子排布式为 。
(2)CB32-的立体构型是(用文字描述) ;其中心原子的杂化轨道类型为 。
(3)根据等电子原理,AB分子的电子式为 ;其中σ键与π键之比为 。
(4)[E(H2O)6]3+内E3+与H2O间的作用力为 。
(5)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
根据相关的化学原理,下列判断正确的是
| A.由于水中存在氢键,所以稳定性:H2O>H2S |
| B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 |
| C.若A2 + 2D— ="=" 2A— + D2,则氧化性D2>A2 |
| D.若R2—和M+的电子层结构相同,则离子半径R2—>M+ |
(8分)已知X、Y、Z、M、W、R是前四周期中的六种元素。X元素原子形成的离子是一个质子,Y原子的价电子构型为2s22p2,Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的。
(1) 24R原子最外层的电子排布图是 ,ZO3-的空间构型是 ;
(2) Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是 ;Y、Z、W三种元素的电负性由大到小的顺序是 。(填元素符号)
(3) Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是 。(填化学式)
(4)ZX4W在物质中,各种粒子间的相互作用力包括 。(填字母编号)
| A.非极性共价键 | B.极性共价键 | C.配位键 | D.离子键 E.氢键 |
下列说法中正确的是( )
| A.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| B.同主族元素形成的氧化物的晶体类型均相同 |
| C.全部由极性键构成的分子一定是极性分子 |
| D.分子晶体中都存在范德华力,可能不存在共价键 |
试题篮
()