A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
下列说法中错误的是
| A.若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 |
| B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 |
| C.CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同 |
| D.短周期元素离子aXm+和bYn-具有相同的电子层结构,则a>b |
(8分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)。
(2)元素C在元素周期表中的位置是 。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。该化合物的电子式是 。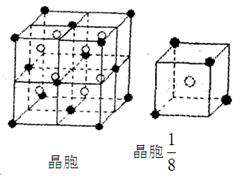
氮是地球上极为丰富的元素
(1)Li3N晶体中氮以N3-的形式存在,基态N3-的电子排布式为 ;
(2)X离子中所有电子正好充满K.L.M三个电子层,它与N3-形成的晶体结构如右图所示。X的元素符号是______,X离子与N3-形成的化合物化学式为______。
(3)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(为按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
A B C D E
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
. (6分)碳族元素包括C、Si、Cu、Sn、Pb。
(1)碳纳米管由单层或多层石墨卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C、SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br键的键角 120°(填“>”“<”或“=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为 ,每个Ba2+与 个O2-配位。
元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置 ; D的最高价氧化物的水化物的化学式为______。
(2)E的气态氢化物在同族元素中沸点最高的原因是: 。
(3)A、C两元素第一电离能前者 后者(填“大于”或“小于”)。无论是A和C的单质还是A和C的氢化物的固体,均能与水剧烈反应生成气体,当上述四种固体分别与足量水反应时,满足n(消耗固体):n(气体):n(转移电子)=1:1:1关系的反应的化学方程式_______________。
(4)B元素能形成多种配合物,如B2+可与NH3形成配离子[B(NH3)4]2+。其配体的空间构型为 ;右图表示B与某种元素X形成的化合物晶胞,如果该化合物中B和X通过离子键结合,该晶体中阳离子的配位数为 。若B和X通过共价键结合,则该化合物的化学式为 (a ZnX b ZnX2 c ZnX3)
(5)A和E可形成离子化合物,其晶胞结构如图示。该化合物的电子式_______。则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是_______。
26.2011年9月29日21时天宫一号在酒泉卫星发射中心发射成功,标志着中国航天迈入了新的台阶,火箭推进剂是成功发射火箭的重要因素。推进剂主要由可燃剂和氧化剂组成,根据化学物质的形态不同推进剂可分为固体推进剂和液体推进剂,它们一般由C、H、O、N中的一种或几种元素组成。请回答下列问题:
(1)已知某固体推进剂主要由可燃剂(聚丁二烯等)和氧化剂甲(一种由三种元素组成的盐)组成,该盐溶液中加入硝酸银溶液,无明显现象,则甲物质所含的化学键类型 ,并用离子方程式表示甲的水溶液呈酸性的原因 。
(2)已知某液体推进剂主要由可燃剂肼(N2H4)和氧化剂乙组成,乙所含有的电子数和肼分子相同,常温下,乙和肼反应生成一种常见的液态化合物和一种常见的稳定单质,试写出该反应的化学方程式 。列举乙的另一种主要用途 。
A.石油产品 B.四氯化碳 C.液氟 D.纯碱
(4)戊也可作液体推进剂的氧化剂,取19.6g化合物戊,隔绝空气加热使其完全分解,生成氮气、氧气和二氧化碳,生成的氮气折合成标准状况下的体积为4.48L,生成的二氧化碳气体被足量的澄清石灰水吸收,得到10.0 g沉淀,生成的氧气折合成标准状况下的体积为 L;戊的化学式为 。
(5)请设计一个实验方案,探究由上述四种元素组成的常见无机盐可能的成份。
__________________________________________
下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
| a |
|
|
|
|
|||||||||||||
| |
|
|
|
b |
c |
d |
|
|
|||||||||
| |
|
|
|
|
e |
f |
|
|
|||||||||
| |
|
|
|
|
g |
|
h |
|
|
|
|
|
|
|
|
|
|
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式___________________________,
h2+中未成对电子数为 。
(2)在b2a2分子中,元素b为 杂化,该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
(3) bd2与bf2比较,沸点较高的是_______(填分子式),原因是 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A.h位于元素周期表中第四周期第VIII族,属于d区元素
B.e的基态原子中,3p能级为半充满,属于p区元素
C.最外层电子排布式为4s2,一定属于IIA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。
下列说法正确的是( )
| A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.HI的相对分子质量大于HF,所以HI的沸点高于HF |
| D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物 |
原子序数由小到大排列的四种短周期主族元素X、Y、Z、W,其中Z、W两原子的核外电子数之和为X、Y两原子核外电子电子数之和的三倍,Y、Z左右相邻,Y、W位于同一主族。下列说法正确的是
| A.Z的氢化物分子间含有氢键,因此Z的氢化物很稳定 |
| B.Y与X不能形成直线型的共价化合物 |
| C.Z和W可形成一种具有较高的硬度和耐磨性的材料,用于制造汽车发动机 |
| D.Y、Z、W形成的单质其晶体类型相同 |
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)B、D、F、G的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)请写出元素H的基态原子电子排布式_____________________。
(3)A的最简单氢化物分子里中心原子采取________形式杂化,A的最高价氧化物分子的空间构型是________。
(4)D的氯化物的熔点比G的氯化物的熔点________(填“高”或“低”),理由是__________________________。
(5)元素C与元素G形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。晶胞中F原子的配位数为________,一个晶胞中F原子的数目为________。
(14分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1) 上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Cu原子的核外电子排布式_____
(2) 根据等电子原理,写出CO分子的结构式_______________。
(3) 甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为________。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3 倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
⑴W元素原子的L层电子排布式为 ,W3分子的空间构型为 ;
⑵化合物M的化学式为 ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔
点较高的原因是 ;
⑶将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中O—C—O的键角约为 ;
⑷X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z= 。
目前已知化合物中数量、品种最多的是IVA碳的化合物(有机化合物),下列关于其原因的叙述中不正确是( )
| A.碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 |
| B.碳原子性质活泼,可以跟多数元素原子形成共价键 |
| C.碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和三键 |
| D.多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合 |
试题篮
()