喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( )
气体 |
溶液 |
|
A. |
H2S |
稀盐酸 |
B. |
HCl |
稀氨水 |
C. |
NO |
稀H2SO4 |
D. |
CO2 |
饱和NaHCO3溶液 |

A.AB.BC.CD.D
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电。下列有关分析正确的是
| A.K3C60和C60中都含有共价键 |
| B.钾的核外电子排布为:1s22s22p63s23p63d104s1 |
| C.K3C60和C60都属于分子晶体,具有较低的熔点 |
| D.C60与12C互为同素异形体 |
[物质结构与性质]过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种分子为 (填化学式);1mol 中含有σ键的数目为 。
中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为 。
【化学一物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素n的基态原子的价电子排布式 ,元素O在周期表的位置是 ,属于 区。
(2)k在空气中燃烧产物的分子构型为 ,中心原子的杂化方式为 ,该分子是 (填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如左下图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填下图中的序号)。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如右下图乙所示。则晶胞中i原子的配位数为 。
X、Y、Z、M、R、W为六种短周期元素,原子序数依次递增。Y、Z、M是同周期元素,且Z、M最外层电子数之差为1。X+ 无电子,—ZX是有机物中常见官能团。Y是组成化合物最多的元素,组成为R ZX的物质能溶解W2Z3型物质。下列说法不正确的是
| A.由X与Y组成的化合物的沸点可能高于由X与Z组成的化合物的沸点 |
| B.X、Z、R三种元素中的任意两种组合成的(1∶1型)物质中均含有共价键 |
| C.常压条件下,沸点:X2Z2>XM ;简单离子半径:Z>M>R>W |
| D.R 3WM6晶体可作为工业电解熔融W2Y3制W单质时的助熔剂 |
A、B是短周期VIIA族的两种元素,A的非金属性比B强。下列关于A、B的说法正确的是
A.A元素的单质可以把B元素的单质从NaB溶液中置换出来
B.NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高
C.HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol
HB分子中H-B键断裂时吸收的能量多
D.常温下,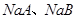 溶液的pH均大于7
溶液的pH均大于7
下列说法正确的是
| A.原子最外层电子数为2的元素一定处于周期表的第IIA族 |
| B.构成单质的分子中一定含有共价键 |
| C.同主族元素形成的氧化物的晶体类型均相同 |
| D.金属与非金属元素形成的化合物可能是离子化合物 |
依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
| A.依据元素的原子序数,推断该元素原子的核外电子数 |
| B.依据原子最外层电子数的多少,推断元素金属性、非金属性的强弱 |
| C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小 |
| D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
下表为元素周期表前四周期的一部分,下列有关W、X、Y、Z四种元素的叙述中,正确的是
| A.与氢原子形成的化学键的键能:W比Y的大 |
| B.与氢原子形成的化学键的极性:X比Y的弱 |
| C.最低价气态氢化物的沸点:X的比W的高 |
| D.XZ3的晶体属于离子晶体 |
近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是
| A.由二氧化碳合成金刚石是化学变化 | B.金刚石是碳的一种同位素 |
| C.钠被氧化最终生成碳酸钠 | D.金刚石中只含有非极性共价键 |
下列物质性质的变化规律,与共价键的键能大小无关的是( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低
④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
黑火药是中国四大发明之一,其爆炸的化学反应方程式是:
2KNO3 + 3C + S→ + N2↑ + 3CO2↑
+ N2↑ + 3CO2↑
(1)方程式中第二周期元素中非金属性由强到弱的顺序依次为 。
(2)上述元素中,元素原子最外层有2个未成对电子的是 。
(3)在生成物中:A物质的晶体类型为 ;构成晶体A的微粒半径大小关系为 (用微粒符号表示);含极性共价键的非极性分子为 。
(4)已知CN—与N2结构相似,写出HCN分子的结构式 。
由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如下,下列说法正确的是
| A.纳米碳管是一种无机化合物 |
| B.纳米碳管中碳原子间以共价键结合 |
| C.纳米碳管与石墨互为同位素 |
| D.0.12g纳米碳管中含有6.02×l022个碳原子 |
碳与硅是十分重要的两种元素,金刚石、SiC具有耐磨、耐腐蚀特性,应用广泛。
(1)碳元素在周期表中的位置是_______________,其原子核外通常未成对电子数为___________个。
(2)已知2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)反应中,被破坏的化学键有________。
a.离子键 b.极性共价键 c. 非极性共价键
(3)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,除去粗产品中少量钠的试剂为_______________。
(4)下列叙述正确的有____________填序号),
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③NaSiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④Si在一定条件下可与FeO发生置换反应
试题篮
()