现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中只有两对成对电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________。
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B2A4、C2A4。
①B2A4的结构式为_________。
②下列有关C2A4的说法正确的是_________。
a.一个该分子中含有4个σ键
b.该分子可作为配位体形成配位键
c.该分子是非极性分子 d.1mol该分子最多可形成4mol氢键
e.该分子的稳定性与氢键无关
f.该分子中C的原子轨道是sp3杂化
(4)B单质的一种的晶体结构如图甲所示,E单质的一种的晶体结构如图乙所示。
则图中的单质B的名称_________,图甲中B原子的配位数与图乙中E原子的配位数之_________。
E元素与D元素形成的ED晶体与NaCl晶体一样,欲比较ED与NaCl的晶格能大小,需考虑的数据是_______________________________________________________________________________。
(5)据最新资料显示,F单质的晶胞可能有多种,若其晶胞分别以六方紧密堆积和面心立方堆积存在时,其单质的密度之比为_________。
铁及铁的化合物在生产、生活中有着重要的用途。
(1) 已知铁是26号元素,写出Fe的价层电子电子排布式________。已知自然界丰度最大的铁的同位素是中子数为30的铁原子,则该种同位素符号________。
(2) Fe原子或离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物,则与之形成配合物的分子的配位原子应具备的结构特征是________。Fe(CO)3一种配合物,可代替四乙基铅作为汽油的抗爆震剂,其配体是CO分子。写出CO的一种常见等电子体分子的结构式________;两者相比较,沸点较髙的是________填分子式)。
(3) 1183K以下纯铁晶体的晶胞如图1所示,1183K以上则转变为图2所示晶胞,在两种晶体中最邻近的铁原子间距离相同。
①图1和图2中,铁原子的配位数之比为________。
②空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中占有的体积百分比,则图1和图2中,铁原子的空间利用率之比为________。
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)E+离子基态时的电子排布式为_______________
(2)A2F的分子空间构型为_____________,FO3分子中F原子的杂化方式 ______________
(3)CA3极易溶于水,其原因主要是______________
(4)从图中可以看出,D 与B形成的离子化合物的化
学式为______________(用元素符号表示),该离子晶体的
密度为ag·cm-3,则晶胞的体积是____________(写出表达式即可,不用化简)
(5)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则 E的晶体中E原子的配位数为
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数与未成对电子数相等,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空: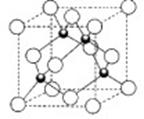
⑴A、B、C的第一电离能由小到大的顺序为 。
⑵D与E的原子化热分别为340 kJ·mol-1和125 kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
⑶分子A2B2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有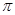 键的数目为 。
键的数目为 。
⑷基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
⑸D的氢化物的晶体结构如图所示,其化学式是 ,图中白球构成的晶体结构是由 (填“密置层”或“非置密层”)按一定的方式在三维空间堆积形成的,写出此氢化物在氯气中燃烧的化学方程式 。
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式 。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为 个、 个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为 、 (各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。 
三聚氰胺分子中氮原子轨道杂化类型是 , 1 mol三聚氰胺分子中 σ键的数目为 。
铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成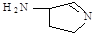 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
| A.离子键 | B.金属键 | C.配位键 | D.非极性键 E.极性键 |
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
(6)铜的某氯化物的晶胞结构如右图所示,该化合物的化学式为 。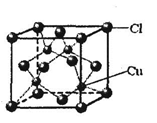
常见元素A、B、C、D,其原子结构的相关信息如下表:
| 元素 |
相关信息 |
| A |
A原子的核外电子总数等于其基态电子层数 |
| B |
B原子的最外层电子数是次外层电子数的2倍 |
| C |
C的基态原子L电子层中有3个未成对电子 |
| D |
D的外围电子层排布为(n+1)d3n(n+2)sn |
请回答下列问题:
(1)A的原子结构示意图是_______;D元素位于周期表第______周期 ______族。
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足______(填字母序号),分子中所有的原子就有可能在同一个平面内。
A.sp3或sp2杂化轨道
B.sp3或sp杂化轨道
C.sp或sp2杂化轨道
(3)如图,在B晶体的一个晶胞中含有______个B原子。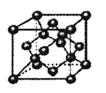
(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3。
①CA3分子是______(填“极性”或“非极性”)分子。
②写出制备C2A4的总反应方程式____________
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示):______________________________
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能 级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最 小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余 能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是_______用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为_______。
(3)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。
(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是_______
(5)已知DE晶体的晶胞如下图所示
若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小 立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原 子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A — A键的键长 为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_____个A原子,该晶体的密度是_____ g/cm
现有A、B、C、D四种短周期元素,它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
| 元素 |
相关结构和性质 |
| A |
其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等。 |
| B |
其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小。 |
| C |
是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多。 |
| D |
原子核外最外层电子排布式为nsnnp2n+1 |
(1)表中所述A的单质晶体中微粒间的相互作用有_____________、_____________。
(2)B元素的氧化物所对应的晶体属于____晶体(填“分子”、“原子”、“离子”、“金属”),工业上制备B元素单质的化学方程式:_______________________。
(3)钠与C元素形成的Na3C晶体中,C元素以C3-存在,C3-的电子排布式为_____________。C元素的气态氢化物溶于水后溶液呈碱性的原因(用方程式表示)_____________(填序号)。
(4)与D同主族的短周期元素,其单质及其化合物与D的单质及化合物均具有的性质为____ (填序号)。
A.常温下单质跟水剧烈反应并放出氧气 B.气态氮化物具有很强的热稳定性
C.气态氢化物极易溶于水并呈强酸性 D.在HXO中X的化合价均为+l价
现有1——20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:
| 元素 |
物质性质或微粒结构 |
| A |
M层上有2对成对电子 |
| B |
B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂 |
| C |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| D |
元素最高正价是+7价 |
(1)元素A的原子最外层共有______种不同运动状态的电子,有___种能量不同的电子。B的
离子与D的离子相互组合形成的干燥剂的化学式是_________。
(2)元素C与氢元素形成带一个单位正电荷的离子,写出该微粒的电子式(用元素符号表示)
_________________
(3)元素A与元素D相比,非金属性较强的是_____(用元素符号表示),下列表述中能证明
这一事实的是_______
A.常温下A的单质和D的单质状态不同
B.A的氢化物比D的氢化物稳定
C.一定条件下D能从A的氢化物水溶液中置换出A单质
D.HD的酸性比HA酸性强
(4)C的氢化物固态时属于______晶体,该氢化物与A的最高价氧化物水化物反应的化学方程式是__________________________________________________。
物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子 b.NH2-中的氮原子
c.ClO3-中的氯原子 d.NO2-中的氮原子
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。
②BH—4的空间构型是 (用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+离子中,N原子是配位原子
d.CN—的电子式为:
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,说明C60是 分子(选填:“极性”、“非极性”);
②1mol C60分子中,含有σ键数目为 。
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为 cm3[用a、NA表示阿伏加德罗常数]。
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致
发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等。
(1)Mn2+在基态时,核外电子排布式为_________。
(2)硫化锌的晶胞结构如图1所示,则每个晶胞中含S2-的数目为________个。
(3)蒽( ,平面结构)属于________(填“极性”或“非极性”)分子。
,平面结构)属于________(填“极性”或“非极性”)分子。
(4)8一羟基喹啉铝具有较高的发光效率。8一羟基喹啉铝的分子结构如图2所示,其分子中存在的相互作用力有_______(填字母)。
A.极性键 B.非极性键 C.金属键 D.氢键 E.配位键
(5)已知铜元素能形成多种化合物。
①CuSO4·5H2O也可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图3所示。下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用SP3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCO-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95。已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为—2价、Cu为+2价和+3价。则该化合物中+2价Cu和+3价Cu的原子个数之比为_______。
X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知:
①x元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且x原子半径小于Q的原子半径;
②Y元素是地壳中含量最多的元素;w元素的电负性略小于Y元素;在w原子的电子排布中,P轨道上只有1个未成对电子;
③Z元素的电离能数据见下表(kJ·mol-1)
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
(1)XY2分子空间构型为____________________________。QX的晶体结构与金刚石的相似,其中X原子的杂化方式为_______________,微粒间存在的作用力是____________。
(2)晶体ZW的熔点比晶体XW4明显高的原因是______________。
(3)氧化物MO的电子总数与QX的相等,则M为_____(填元素符号)。MO是优良的耐高温材料,其晶体结构与ZW晶体相似。MO的熔点比CaO的高,其原因是___________________________________。
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价含氧酸根离子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
(4)基态D原子的核外电子排布式为 ,下图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
试题篮
()