原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E元素原子序数为29。请用元素符号或化学式回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为 ;
(2)已知YZ2+与XQ2互为等电子体,则1 mol YZ2+中含有π键数目为_______;
(3)Z的气态氢化物沸点比Q的气态氢化物高的多,其原因是 ;
(4)X、Z与氢元素可形成化合物H2X2Z4,常用作工业除锈剂。H2X2Z4分子中X的杂化方式为 ;
(5)E原子的核外电子排布式为 ;E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图所示,该晶体的化学式为 。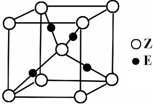
Ⅰ.含氮化合物西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
| 分子式 |
结构简式 |
外观 |
熔点 |
溶解性 |
| C12H10ClN3O |
 |
白色结晶粉末 |
170~172℃ |
易溶于水 |
(1)氯吡苯脲的晶体类型为_______ ,所含第二周期元素第一电离能从大到小的顺序为
________________(用元素符号表示)。
(2)氯吡苯脲熔点低,易溶于水的原因分别为 _ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
异氰酸苯酯 2-氯-4-氨基吡啶 氯吡苯脲
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键。
(4)含氮的化合物氨气水溶液逐滴加入硝酸银溶液中制备银氨溶液,写出银氨溶液的配制过程中沉淀溶解的离子方程式 。
Ⅱ.下列是部分金属元素的电离能
| |
X |
Y |
Z |
| 第一电离能(kJ/mol) |
520.2 |
495.8 |
418.8 |
(5)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为:
。
(6)RCl可用作有机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如下图所示。元素R基态原子的电子排布式 _ ,
与同一个Cl-相连的 R+有 个。
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)C、N、O三种元素第一电离能从大到小的顺序是 。
(3)(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(1)+2N2H4(l) 3N2(g)+4H2O(g)△H=" —103" 8.7kJ.mol—1,若该反应中有4mol N—H键断裂,则形成的
3N2(g)+4H2O(g)△H=" —103" 8.7kJ.mol—1,若该反应中有4mol N—H键断裂,则形成的 键有 mol。
键有 mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(4)氮化硼(BN)是一种重要的功能陶瓷材料,在与石墨结构相似的六方氮化硼晶钵中,层内B原子与N原子之间的化学键为___ 。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为3.615×l0—10m,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g.cm一3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的内部各能层均排满,且有成单电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式 。
(2)A的单质分子中 键的个数为 。
键的个数为 。
(3)A、B、C三种元素第一电离能由大到小的顺序为 (用元素符号表示)
(4)B元素的氢化物的沸点是同族元素中最高的,原因是 。
(5)A的最简单氢化物分子的空间构型为 ,其中A原子的杂化类型是 。
(6)C和D形成的化合物的晶胞结构如图,已知晶体的密度为 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用 、NA的计算式表示)
、NA的计算式表示)
已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26。
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
回答下列问题:
(1)B元素原子核外已成对电子数是未成对电子数的____倍。
(2)X、Y、Z的电负性从大到小的顺序为____(用元素符号表示)。
(3)分子式为A2B、A2E的两种物质中 __更稳定(用化学式表示),原因是____。
(4)X的氯化物的熔点比Y的氯化物的熔点____,原因是____。
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为____。等电子体指的是原子总数相同.价电子总数相同的分子.离子或基团,据此定义写出离子SCN—的一种等电子体____。
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为- 20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)5的晶体类型为 。F元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如
图所示。在面心立方晶胞中F原子的配位数为____,体心立方晶胞的密度可表示为____。(F的原子半径为r)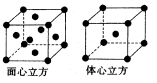
科技日报报道:辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势。从不同角度观察MoS2的晶体结构见图。已知:Mo位于第五周期VIB族。
(1)晶体硅中硅原子的轨道杂化类型为______。
(2)电负性:C______S(填“>”或“<”)。
(3)晶体硅和C60比较,熔点较高的是______。
(4)Mo元素基态原子的价电子排布式为____________。
(5)根据MoS2的晶体结构回答:
①每个Mo原子周围距离最近的S原子数目为______。
②Mo-S之间的化学键为______(填序号)。
A极性键;B非极性键;C配位键;D金属键;E范德华力
③MoS2纳米粒子具有优异的润滑性能,其原因是______。
铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)基态铬原子的价电子排布式为 。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:K2Cr2O2+3CCl4 2KC+2CrO2Cl2+3COCl2↑。
①上述反应式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于 晶体。
③COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO FeO(填”<”、 “=”或 “>”)。
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图。下列说法不正确的是 (填标号)。
| A.该复合物中存在化学健类型只有离子键、配位键 |
| B.该复合物中Cl原子的杂化类型为sp3 |
| C.该复合物中只有CO和H2O作为配位体 |
| D.CO与N2的价电子总数相同,其结构为C=O |
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
铜锢稼硒(CIGS )等化合物薄膜太阳能电池是第三代太阳能电池之一。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为 。
(2)砷、硒、溴为第4周期相邻元素,其中电负性最大的是 (填元素符号,下同);第一电离能最小的是 。
(3)硼、铝与镓处于同一主族。
① AlC13在NaCl、KCl融烙盐中能形成A12C17-其结构如图所示。其中A1 原子的杂化轨道类型为 ,配位键数目为 。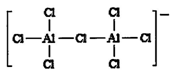
②B元素可形成B70单质,它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为 ,该化合物中的化学键类型有 。
| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
不锈钢的种类很多,其中一种铁元素以外,还含有较多的Cr(铬)、Ni(镍)、Mo(钼),少量的Si(硅)、C(碳),微量的S(硫)、P(磷)。
(1)上述元素中属于第三周期且第一电离能从大到小排列的是_______
(2)Mo(钼)处于第五周期,且与Cr(铬)元素位于同一族,则基态Mo(钼)原子的外围电子(价电子)排布式是_______。
(3)CH4的沸点比SiH4低,原因是_______。
(4)镍元素能形成多种配合物,配离子[Ni(CN)4]2—中不含有的是____(填选项编号)。
| A.离子键 | B.配位键 | C.σ键 | D.π键E.氢键 |
(5)碳元素有多种单质,其中C60分子有独特的球形结构:C60分子中原子轨道杂化类型是_______。
(6)碳的另一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加人镁原子层,两层俯视图:
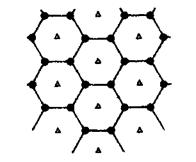
该材料的化学式为_______。
(1)铬的外围电子排布式是 ,与铬同周期,最外层有3个未成对电子数的主族元素名称是 ,该元素对应的最低价氢化物分子的中心原子采取了 杂化方式,分子的空间构型是 。
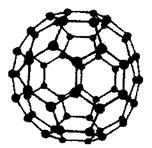
(2)富勒烯(C60)的结构如图,1molC60分子中σ键的数目为______ 。继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是: 。
(3)氟化氢水溶液中存在氢键有 种。
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是 ,锰与X在准晶体中的结合力为 。
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如下表:
| 元 素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。 某镍配合物结构如图所示,分子内含有的作用力有 (填序号)。
A氢键;B离子键;C共价键;D金属键;E配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(6)铁能与氮形成一种磁性材料,其晶胞结构如图所示,则该磁性材料的化学式为 。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为 。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为 。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(4)互为等电子体的微粒相互之间结构相似。I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 ,中心原子杂化类型为 。
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为 (填序号)。
(6)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式 。
(7)如图所示为卤化物冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 。
氮、磷、锌是与生命活动密不可分的元素。请回答下列问题:
(1)NH3和pH3都是极性分子,其中极性较大的是______,理由是______。
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是______。
(3)氮化硼(BN)的一种晶体结构与金刚石相似,则B-N-B之间的夹角是____________。氮化砸的密度为3.52g/cm3,则B-N键的键长是______pm (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(4)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是____________;
②中和20mL0.1mol/L次磷酸(H3PO2)溶液需要0.1mo/L NaOH溶液的体积恰好为20 mL,则H3PO2的结构式是____________。
(5)Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是________________________
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为
_____,I和Cl相比,电负性较大的是_____。
(2)基态溴原子的电子排布式为_____,碘原子价电子的电子排布图为_____。
(3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______,中心I原子的杂化轨道类型为
__________。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5) 离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm( pm=10-12m), RbICl2晶胞中含有______个氯原子,RbICl2晶体的密度是_____g•cm3(只要求列箅式,不必计算出数值。阿伏伽德罗常数为NA)。
已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| A |
原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B |
原子核外M层电子数是N层电子数的4倍 |
| C |
是使用最为广泛的合金的主要成分 |
| D |
原子各内层电子均已饱和,最外层电子数为1 |
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____ ,D元素原子的外围电子排布式为
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____ 。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____ ,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____
a:CO2 b:SO2 c:NH3 d;CH4
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____ ,与B离子最近且等距的A离子的个数为 。
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为___ _(可用根号表示)。
试题篮
()