[化学一选修3:物质结构与性质]第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1)基态Ni原子核外电子排布式为_______;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________。金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)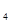 ,该分子呈正四面体构型。试推测Ni(CO)
,该分子呈正四面体构型。试推测Ni(CO)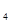 的晶体类型为________,Ni(CO)
的晶体类型为________,Ni(CO)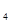 易溶于下列_______(填选项字母)中。
易溶于下列_______(填选项字母)中。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
(2)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO_________FeO(填“>”或“<”),原因为_____________;黄血盐是一种配合物,其化学式为K4[Fe(CN)6] ·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_______________。
(3)酸性高锰酸钾溶液能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20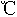 水中的溶解度之比为0.39,其原因为_________。
水中的溶解度之比为0.39,其原因为_________。
(4)在铬的硅酸盐中,SiO44-四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为________,其化学式为_________。
化学中的某些元素是与生命活动密不可分的元素,请回答下列问题。
(1)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。
①维生素C分子中碳原子的杂化方式有 。
②1 mol维生素C分子中含有 mol π键。
③维生素C分子中所含元素电负性由大到小的顺序 为 。
④维生素C晶体溶于水的过程中要克服的微粒间作用力有 。
(2)KSCN溶液可用于Fe3+的检验,原因是铁离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物。Fe3+的价电子排布为 ,与之形成配合物的分子或离子中的配位原子应具备的结构特征是 。
(3)Fe3O4具有反尖晶石结构。某化合物MgxAlyOz与反尖晶石结构相仿,其结构如下图所示,它是由下列A、B方块组成。该化合物的化学式为________。
(选做)铜是过渡金属元素,可以形成多种化合物。
(1)铜基态原子的核外电子排布式为 。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。
[Cu(NH3)n]+中Cu+与n个氮原子的空间结构呈 ,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(en)2]2+(en是乙二胺的简写):
请回答下列问题:
①乙二胺分子中氮原子轨道的杂化类型为 。
②配合物[Cu(en)2]Cl2中属于第二周期且第一电离能从大到小排列的是 。
③乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是 。
④配合物[Cu(en)2]Cl2中不存在的作用力类型有 (填字母)。
| A.配位键 |
| B.极性键 |
| C.离子键 |
| D.非极性键 |
E.氢键
F.金属键
(4)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构单元如图所示。
写出该反应的离子方程式__________________。
(【化学—物质结构与性质】1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)Mn和Fe的部分电离能数据如表:
| 元 素 |
Mn |
Fe |
|
| 电离能/kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为________。
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| |
分子式 |
结构简式 |
熔点 |
沸点 |
水溶性 |
| 乙醇 |
C2H6O |
C2H5OH |
-114.3℃ |
78.4 °C |
互溶 |
| 二甲醚 |
C2H6O |
CH3OCH3 |
-138.5℃ |
-24.9℃ |
微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式 (标出配位键);深蓝色晶体中不存在的微粒间作用力有 。
A.范德华力
B.离子键
C.共价键
D.金属键
E.配位键
[《物质结构与性质》选考题]现代世界产量最高的金属是Fe、Al、Cu。
(1)Fe、Al、Cu三种元素第一电离能由高到低的排序为 ;Fe2+的电子排布式为 。
(2)Cu(OH)2溶于浓氨水形成 色铜氨溶液;乙二酸( )分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
)分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
(3)以下变化伴随化学键破坏的是 (填下列选项标号)
| A.冰融化 | B.铝气化 | C.AlCl3溶于水 | D.胆矾受热变白 |
(4)二氧化硅晶体结构示意图如下,每个氧原子最近且等距离相邻 个氧原子。
【化学──物质结构与性质】某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应)。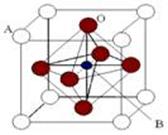
(1)用A、B、O表示这类特殊晶体的化学式 。在图中,与A原子配位的氧原子数目为 。
(2)基态Cr原子的核外电子排布式为 ,其中电子的运动状态有 种。
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为 。
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 |
CaCO3 |
SrCO3 |
BaCO3 |
| 热分解温度/℃ |
900 |
1172 |
1360 |
| 阳离子半径/pm |
99 |
112 |
135 |
请解释碳酸钙热分解温度最低的原因:___________________________________。
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为558pm。又知钙的密度为1.54g·cm-3,则1cm3钙晶体中含有 个晶胞,阿伏伽德罗常数为 (列式计算)。
(12分)X、Y、Z、R为短周期元素且原子序数依次增大。X、R原子核外电子层数等于其最外层电子数,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z的两种同素异形体都存在于大气中,对生命起着重要作用。另有M元素位于周期表的第4周期第6列。请回答下列问题:
(1)上述5种元素中,电负性最大的是(填名称) ,X3Z+的VSEPR模型名称是 。
(2)M基态原子的电子排布式是 ;
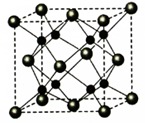
(3)R的单质为面心立方最密堆积(见下图),则一个晶胞中R原子数为 ,R的配位数是 。
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是 .
(13分) X、Y、Z、R为短周期元素,原子序数依次增大。X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等。
(1)R位于元素周期表第_①_____周期,第_②______族。
(2)X、R元素的最高价氧化物对应的水化物中,酸性较强的是_______。(填化学式)
(3)Y元素所在周期中,电负性最大的元素是_______。
(4)X和R形成的物质是一种超硬材料,其晶胞结构如图所示,晶胞中X原子的个数是________。
(5)X的单质完全燃烧生成的产物分子中,σ键与π键的数目之比是_______。
(6)Y和Z所形成的化合物ZY难溶于水,但易发生水解。ZY在NaOH溶液中水解的离子方程式是__________________________________________。
物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。在基态原子中,核外存在对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是。
(3)
分子中,共价键的类型有,
原子的杂化轨道类型是,写出两个与
具有相同空间构型和键合形式的分子或离子。
(4)
能与金属
形成
,该化合物的熔点为253
,沸点为376
,其固体属于晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
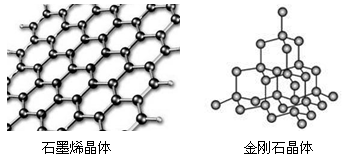
①在石墨烯晶体中,每个
原子连接个六元环,每个六元环占有个C原子。
②在金刚石晶体中,
原子所连接的最小环也为六元环,每个
原子连接个六元环,六元环中最多有个
原子在同一平面。
、
、
、
为原子序数依次增大的四种元索,
和
具有相同的电子构型;
、
为同周期元索,
核外电子总数是最外层电子数的3倍;
元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是(填元素符号),其中原子的核外电子排布式为。
(2)单质有两种同素异形体,其中沸点高的是(填分子式),原因是;
和
的氢化物所属的晶体类型分别为和。
(3)和
反应可生成组成比为1:3的化合物
,
的立体构型为,中心原子的杂化轨道类型为。
(4)化合物的立体构型为,中心原子的价层电子对数为,单质D与湿润的
反应可制备
,其化学方程式为。
(5)和
能够形成化合物
,其晶胞结构如图所示,晶胞参数,
=0.566
,
的化学式为:晶胞中
原子的配位数为;列式计算晶体F的密度(
)。
氟在自然界中常以的形式存在。
(1)下列关于的表述正确的是。
a.与
间仅存在静电吸引作用
b.的离子半径小于
,则
的熔点高于
c.阴阳离子比为2:1的物质,均与晶体构型相同
d.中的化学键为离子键,因此
在熔融状态下能导电
(2)难溶于水,但可溶于含
的溶液中,原因是(用离子方程式表示)。
已知在溶液中可稳定存在。
(3)通入稀NaOH溶液中可生成
,
分子构型为,其中氧原子的杂化方式为。
(4)与其他卤素单质反应可以形成卤素互化物,例如
、
等。已知反应
,
键的键能为
,
键的键能为
,则
中
键的平均键能为
。
的熔、沸点比
的(填"高"或"低")。
(12分)【选做题】本题包括A、B两小题,请选定一中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]下列反应曾用于检测司机是否酒后驾驶:
2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_________;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为______________;1molCH3COOH分子中含有δ键的数目为______。
(3)与H2O互为等电子体的一种阳离子为________(填化学式);H2O与CH3CH3OH可以任意比例互溶,除因为它们都是极性分子外,还因为___________。
[选修3—物质结构与性质]
19—Ⅰ下列物质的结构或性质与氢键无关的是 。
| A.乙醚的沸点 | B.乙醇在水中的溶解度 |
| C.氢化镁的晶格能 | D.DNA的双螺旋结构 |
19—Ⅱ钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
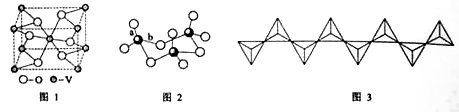
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长由两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
科学家正在研究温室气体
和
的转化和利用。
(1)
和
所含的三种元素电负性从小到大的顺序为。
(2)下列关于
和
的说法正确的是(填序号)。
a.固态
属于分子晶体
b.
分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以
熔点低于
d. 和 分子中碳原子的杂化类型分别是 和
(3)在
基催化剂作用下,
和
反应可获得化工原料
和
.
①基态
原子的电子排布式为,该元素位于元素周期表的第族。
②
能与
形成正四面体形的配合物
,1
中含有
键。
(4)一定条件下,
和
都能与
形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。
与
形成的水合物俗称"可燃冰"。
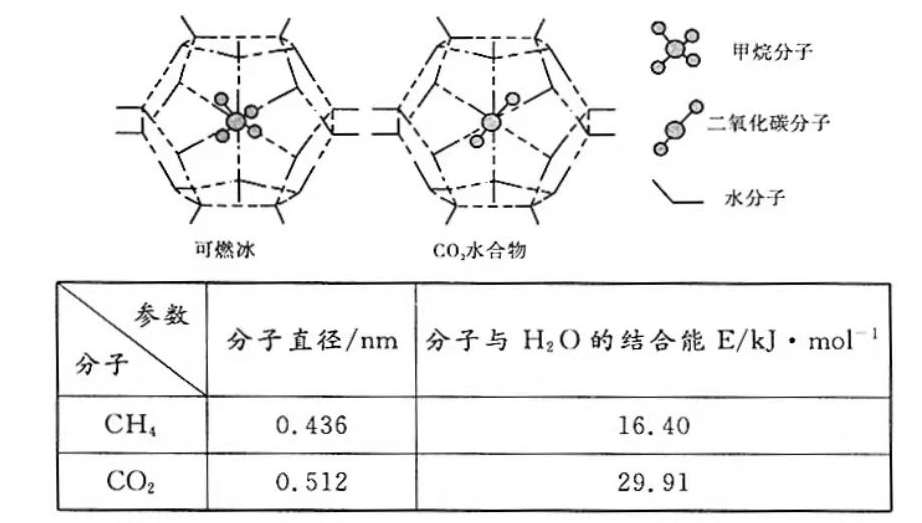
①"可燃冰"中分子间存在的2种作用力是。
②为开采深海海底的"可燃冰",有科学家提出用
置换
的设想。已知上图中笼状结构的空腔直径为0.586
,根据上述图表,从物质结构及性质的角度分析,该设想的依据是。
(化学——物质结构与性质,13分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
| A |
|
|
||||||||||||||||
| |
|
|
|
M |
Q |
R |
|
|
||||||||||
| |
|
E |
|
|
|
D |
|
|||||||||||
| |
|
|
G |
|
|
|
J |
|
|
|
|
|
|
|
|
|
|
|
请回答下列问题:
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的J原子有 个。该晶体属于 晶体
A.离子晶体 B.原子晶体 C.分子晶体 D.金属晶体
(2)M3R2是一种直线型分子R=M=M=M=R,该分子是一种 分子(填极性或非极性)。
(3)请写出D-的电子排布式: 。
(4)M2A2也是直线型分子,1个分子中含有 个σ键。
(5)化合物E2D6分子中各原子均达到了八电子稳定结构,请画出其结构式(用元素符号表示) 。
试题篮
()