【化学一选修3:物质结构与性质】(15分)
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①1mol PAN中含有的σ键数目为_______。PAN中除H外其余三种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为_______,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是___________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键
b.共价键
c.配位键
d.范德华力
e.氢键
②NH4NO3中阳离子的空间构型为_____,阴离子的中心原子轨道采用_______杂化。
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
【化学—选修3物质结构与性质】(1)A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(KJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
根据上述信息,写出B的基态原子核外电子排布式 ,预测A和氯元素形成的简单分子空间构型为 。
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为 ,中心离子的配位数为 。
(3)参考下表中的物质熔点回答下列问题
| 物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
| 熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律 。
(4)C60可用作储氢材料。C60的结构如图1。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为 。
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol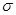 键。
键。
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用含a、b、c的式子表示)。
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
【化学—物质结构与性质】石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)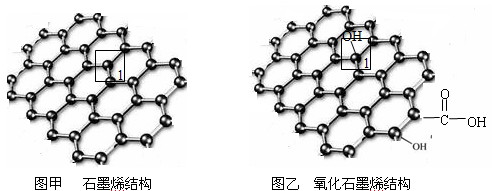
(1)图甲中,1号C与相邻C形成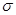 键的个数为____________________________。
键的个数为____________________________。
(2)图乙中,1号C的杂化方式是________________,该C与相邻C形成的键角_______(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散到H2O中,则氧化石墨烯可与H2O形成氢键的原子有_________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为_____________,该材料的化学式为__________。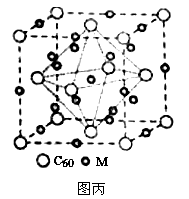
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜晶胞的体积是 cm3、晶胞的质量是 g,阿伏加德罗常数为 (列式计算,已知A1(Cu)=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方程式为 。
选做[化学—选修3:物质结构与性质] (15分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)R核外电子排布式为__________________。
(2)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别为__________,ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_____________(填化学式),原因是_________________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为______________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为____________(填化学式)。Na+的配位数为_____________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则两个最近的W离子间距离为 nm(用含ρ、NA的计算式表示)。
[化学—选修3:物质结构与性质]Fe2+、Fe3+与O22—、CN—、F—、有机分子等形成的化合物具有广泛的应用。
(1)N、O、F三种元素原子的第一电离能由大到小的顺序是 。
(2)基态Fe3+核外M能层的电子排布式为 。
(3)铁有δ、γ、α三种同素异形体(如下图),则γ晶胞原子堆积名称为_____________。假设各种晶型的铁单质都是由半径为r的铁原子堆积而成,则晶胞δ与晶胞α的密度比为_______________(列式并化简)。
(4)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。此物质中碳原子的杂化方式有 。
(5)配合物K3[Fe(CN)6]可用于电子传感器的制作。与配体互为等电子体的一种分子的电子式为 。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为 。
(6)F—不仅可与Fe3+形成[FeF6]3—,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。该晶体的化学式为 。在该晶体中与一个F—距离最近且相等的F—的个数为 。
【化学——物质结构与性质】选做X、Y、Z、L四种元素分别位于周期表中三个紧邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。该原子核外电子排布式是 。其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体,1mol该化合物含有的化学键数目为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个σ键, 个π键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。
【化学—物质结构与性质】硼及其化合物在现代工业、生活和国防中有重要应用价值。
(1)硼原子的电子排布式是 。
(2)最简单的硼烷是B2H6(乙硼烷),结构见下图,其中B原子的杂化方式为 。
(3)BF3和BCl3都有强烈接受孤电子对的倾向,如三氟化硼气体与氨气相遇,立即生成白色固体,写出该白色固体结构式,并标注出其中的配位键 。
(4)近年来,人们肯定硼是人和动物氟中毒的重要解毒剂。硼在体内可与氟形成稳定的配合物 ,并以和氟相同的途径参加体内代谢,但毒性比氟小,且易随尿排出,故认为硼对氟化物具有解毒作用。
(5)经结构研究证明,硼酸晶体中B(OH)3单元结构如图(1)所示。各单元中的氧原子通过O—H…O氢键连结成层状结构如图(2)所示。层与层之间以微弱的分子间力相结合构成整个硼酸晶体。
①H3BO3是一元弱酸,写出它与水反应的化学方程式 ,
②根据结构判断下列说法正确的是 。
a.硼酸晶体属于原子晶体
b.硼酸晶体有鳞片状的外层
c.硼酸晶体是分子晶体
d.硼酸晶体有滑腻感,可作润滑剂
e.在B(OH)3单元中,B原子以sp3杂化轨道和氧原子结合而成
f.H3BO3分子的稳定性与氢键有关
g.含1mol H3BO3的晶体中有3mol氢键
h.分子中硼原子最外层为8e-稳定结构
③硼酸常温下为白色片状晶体,溶于水(273K时溶解度为6.35),在热水中溶解度明显增大(373K时为27.6)。请分析其中原因 。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道接受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为_______。
(2)A、B、C、D四种元素中电负性大小顺序的是__________________。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为_______________。
(4)下列叙述正确的是______(填序号)。
a.M是极性分子,N是非极性分子
b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
②已知:Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol;
2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:_________。
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)==2CA3(g)ΔH<0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
①试比较K1,K2的大小,K1________K2(填写“>”、“=”或“<”)。
②在40 0 0C时,当测得CA3 和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的v(C2)正____v(C2)逆(填写“>”、“= ”或“ < ”)。
选做【化学物质结构与性质】右图a~f分别表示由H、C、N、Na、Si、Cu元素组成的单质,其中c、d均为热和电的良导体。单质分别对应的熔点如图所示:
(1) 从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为 ;
从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为 ;
(2)图中d单质对应元素原子的电子排布式 。用价层电子对互斥理论推断,单质a、b、f对应的元素以原子个数比1:1:1形成的分子中化学键的键角为 。
(3)a与b的元素形成的10电子中性分子X,X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为 。
(4)上述六种元素中的一种元素形成的含氧酸分子的结构模型(原子共平面)如图:
则可判断该元素原子(中心原子)的杂化方式是 。氮化硅是一种高温陶瓷材料,硬度大、熔点高、化学性质稳定,其基本结构单元如图,则其化学式为_______。
【化学—物质结构与性质】W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体。X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列各题:
(1)写出X的基态原子的核外电子排布式_________________;
(2)比较X、Y两元素基态原子的第一电离能大小:X_____Y(填“>”、“<”或“=”),理由是___________________;
(3)W、X两元素能形成一种常见气体M,每个M分子中含有l0个电子,M分子中心原子的杂化方式为______;W、X两种元素还能形成一种常见阳离子N,每个N中也含有10个电子,但在N与M中所含化学键的键角大小不同,其原因是______________;
(4)Z2+可与M分子在水溶液中形成[Z(M)4]2+,其中M分子和Z2+通过____________结合;
(5)单质Z的晶胞结构如图所示,则每个晶胞中含有原子Z的个数为______________。
【化学、选修3--物质结构和性质】
I.如图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2,
请回答:
C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。
请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_______,1 mol该分子中含有π键的数目为______。该分子中碳原子的杂化轨道类型是_______,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
[化学---选修3:物质结构与性质](15分)太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VIA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 (用元素符号表示)。
(3)SeO3分子的立体构型为 。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。
(5)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(6)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(7)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
试题篮
()