选做(15分)【化学选修3:物质结构与性质】
原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满。请回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)已知YZ2+ 与XQ2互为等电子体,则l mol YZ2+ 中含有π键数目为 。
(3)Z的气态氢化物沸点比Q的气态氢化物高得多,其原因是 。
(4)Y、Z与氢元素可形成化合物HYZ3,是实验室常用试剂。HYZ3分子中Y的杂化方式为 ,YZ3—的空间构型是 。
(5)E原子的价层电子排布式为 ;E有可变价态,它的基价态的离子与Z的阴离子形成晶体的晶胞如图所示。
①该晶体的化学式为 ,Z的阴离子的配位数为 。
②Z的阴离子的堆积模型为 。
A.简单立方 B.六方最密 C.面心立方
③已知晶胞边长为apm,则晶胞的密度为 g• cm—3(阿伏加德罗常数用NA表示)。
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长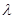 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
| 共价键 |
C—C |
C—N |
C—S |
| 键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填字母)。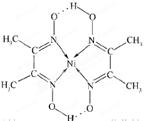
A.离子键 B.共价键 C.配位键 D.氢键
选做(12分)【化学一物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布式为_________,第一电离能最小的元素是__________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式)。
(3)B元素可形成多种单质。一种晶体结构如图一所示,其原子轨道的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为_________g·cm-3(保留两位有效数字)。(已知: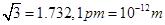 )
)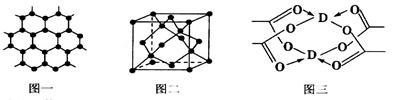
(4)D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。请写出沉淀溶解的离子方程式:_________________。
(12分)【化学——物质结构与性质】硼在半导体工业中被大量用作半导体掺杂物,同时含硼化合物在杀虫剂、防腐剂及新型储氢材料的制造中也有重要的地位。请回答下列问题:
(1)在第2周期的元素中,基态原子的第一电离能小于硼的元素有_________种。
(2)硼砂是人们最早使用的含硼化合物之一,其阴离子Xm-( Xm-中只含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型分别为_____、_____;图中标注为2号的原子与相邻原子成键形成的键角_____4号原子与相邻原子成键形成的键角(填“大于”“小于”或“等于”)。在下列各项中,在Xm-内不存在的化学键是____(填下列序号字母)。
a.离子键 b.共价键 c.配位键
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料。镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=____。氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则在下列各项中,立方氮化硼晶体不可用作______(填下列序号字母)。
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头
选做【化学——物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为______。
②BH4-的空间构型是________(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用 ,实现储氢和输氢。下列说法正确的是________。
,实现储氢和输氢。下列说法正确的是________。
a.[Cu(NH3)4]2+中,N原子是配位原子
b.NH3分子中氮原子的轨道杂化方式为sp2杂化
c.键角NH4+<NH3
d.相同压强时,NH3的沸点比PH3的沸点高
(3)富氢材料NH3和F2在Cu催化剂存在下反应直接得到NF3
上述化学方程式中的5种物质所属的晶体类型有________(填序号)
a.离子晶体 b.分子晶体
c.原子晶体 d.金属晶体
(4)某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为________________。
【化学—物质结构与性质】金属及其合金应用广泛。
(1)与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是___________________。
(2)下图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,b点对应的元素为______(填元素符号)。
(3)乙醇可被三氧化铬(CrO3)氧化为乙醛(CH3CHO)。乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是_____________________。
(4)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
(5)元素Al与元素Fe形成某种晶体结构如图所示。若晶胞的边长为a nm,则合金的密度为_______g·cm—3。
I.下列说法中正确的是 。
| A.第一电离能由大到小的顺序为O>N>C |
B.由于C 和O 和O 互为等电子体,所以可以推断O 互为等电子体,所以可以推断O 的电子式为 的电子式为 |
| C.根据岩浆晶出规则,Ca0比Mg0更容易在岩浆冷却过程中先结晶 |
| D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
Ⅱ.(1)兰聚氰胺分子的结构简式如图所示,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol 键。
键。 
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为____ 。
(3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。
(4)碳化硅的晶胞结构(如右图)与金刚石类似(其中“●”为碳原子,“○”为硅原子)。图中“●”点构成的堆积方式与下列图式中 所表示的堆积方式相同。

(5)碳化硅的结构中,与碳原子距离最近且相等的碳原子有 个。设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用含a、b、c的式子表示)。
【化学——选修3:物质结构与性质】
I.S4N4的结构如图:
(1)S4N4的晶体类型是__ _。
(2)用干燥的氨作用于S2Cl2的CCl4,溶液中可制S4N4。化学反应方程为:6S2Cl2+16NH3= S4N4 +S8+12NH4Cl
①上述反应过程中,没有破坏或形成的微粒间作用力是__ _。
a.离子键
b.极性键
c.非极性键
d.金属键
e.配位键
f.范德华力
②S2Cl2中,S原子轨道的杂化类型是 __ __。
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
(3)基态Cu2+的最外层电子排布式为_ _。
(4)二甘氨酸合铜(II)中,第一电离能最大的元素与电负性最小的非金属元素可形成多种微粒,其中一种是5核10电子的微粒,该微粒的空间构型是 _ 。
(5)lmol二甘氨酸合铜(II)含有的二键数目是 _。
(6)二甘氨酸合铜(II)结构中,与铜形成的化学键中一定属于配位键的是 ______(填写编号)。
[化学—选修3:物质结构与性质]在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子。
(1)写出基态E原子的价电子排布式 。
(2)B、C、D三种元素第一电离能由小到大的顺序为 (用元素符号表示)。
(3)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式 。
(4)A2D的沸点在同族元素中最高,其原因是 。A2D由液态形成晶体时密度 (填“增大”、“不变”或“减小”),其主要原因 (用文字叙述)。
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为 (用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g·cm-3(用含a、NA的符号表示)。

【化学——选修3 物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式: 。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为 ,eg3、e2g6中心原子e的杂化方式分别为 、 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式: 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 |
f—f |
g—g |
h—h |
i—i |
| 键能(kJ/mol) |
157 |
242.7 |
193.7 |
152.7 |
试从原子半径角度阐述f—f键键能反常的原因: 。
(5)c元素的元素符号是 ,价电子排布式为 ,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为: 。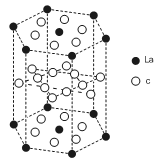
【原创】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,B的最简单气态氢化物能引起温室效应,C的氧化物是导致光化学烟雾的主要原因,D原子核外电子有8种不同的运动状态, E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子。
(1)写出基态E原子的价电子排布式 。
(2)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;
(3)根据等电子体原理,写出BD化合物的电子式 ;
(4)A2D由液态形成晶体时密度减小,主要原因是 (用文字叙述)。
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为
(用元素符号表示);该化合物在稀硫酸中发生歧化反应,写出该化学反应方程式 。


已知A、B、C、D、E、F、G七种元素原子序数均小于36,它们的核电荷数依次增大。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的基态电子排布中L能层有两个未成对电子,E和D同主族;F原子的基态电子排布中有4个未成对电子;G与F在周期表中同族,且G原子的外围电子排布中有2个未成对电子。根据以上信息填空:
(1) B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)
(2)F2+离子的价层电子排布图是 ,
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,E元素的氢化物的VSEPR模型为 。
(4)A和C形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物_____(填化学式);其中心原子C的杂化方式为 。
(5)化合物BD2、C2D和阴离子EBC-互为等电子体,它们结构相似,EBC-的电子式为 。F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为_______;
(6)GD的晶体结构与氯化钠相同,在晶胞中G离子的配位数是_______;已知晶胞的边长为a nm,晶体的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则晶体的密度为_________g·cm-3。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若都做,则按A小题评分。
【改编】A.[物质结构与性质]磷化硼是一种高折射率红棕色晶体,可通过单质B与Zn3P2(或PH3)反应,也可热解PCl3·BCl3制得。
(1)锌原子基态时核外电子排布式为 。
(2)BCl3中硼原子的杂化轨道类型为 ,PH3空间形状为 (用文字描述)。
(3)PCl3能够与配合物Ni(CO)4发生配体置换反应:Ni(CO)4 +4PCl3 = Ni(PCl3)4 +4CO。
①与CO互为等电子体的一种分子的化学式为 。
②1molPCl3中含 键数目为 。
键数目为 。
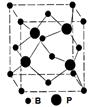
(4)立方BP的晶胞结构如图所示,晶胞中含B原子数目为 。
发展低成本、新型太阳能是解决未来社会能源问题的有效途径。目前,太阳能电池的发展已经进入了第三代,其常用材料除单晶硅,还有铜铟镓硒等化物质。完成下列填空:
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式_________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能从大到小顺序(用元素符号表示) 。
(3)硼元素与镓元素处于同一主族,三氟化硼分子的空间构型是___________;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B—X键都当作单键考虑来计算键长,理论值与实测键长结果如下表。硼卤键长实测值比计算值要短得多,可能的原因是______________。

(4)金属铜能形成多种配合物,如复合物氯化羰基亚铜[Cu2C12(CO)2·2H2O],其结构如图。

①该配合物中Cl原子的杂化类型为____________。
②该配合物中的配位体有_____________种。
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为 ;
(6)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子,则得如图所示的金刚砂(SiC)结构。在SiC中,每个C原子周围最近的C原子数目为_____;若SiC晶体密度为a g.cm-3,SiC的摩尔质量为M g.mol-1,阿伏伽德罗常数用NA表示,则Si与C最近的距离为 pm (列式表示)。

[化学——选修3:物质结构与性质] 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。请填写下列空白。
(1)e元素基态原子的核外电子排布式为____________。
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为____________(填元素符号),其原因是__________________。
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写出两种)。
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲________,乙 ;甲高温易转化为乙的原因是__________________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为 ,该化合物加热时首先失去的组分是 ,判断理由是 。
试题篮
()