.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。
(1)请写出铜与稀硝酸反应的化学方程式:
。
(2)若证明无色气体是NO的实验操作和现象是 。
一氧化氮是大气污染物之一。目前,有一种治理方法是在400 ℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水。该反应的化学方程式为
每有10mol N2生成,被还原的氧化剂为_______mol。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体为 ,将此气体通入水中,发生反应的化学方程式为: 。
[广东卷] 某小组用如图装置及药品(部分略去)探究工业制硫酸的过程。

(1)检查完装置的气密性,加入药品开始实验,此时首先应进行的操作是
(2)实验时A中氧气导管冒出的气泡与SO2导管冒出的数量相近,目的是: ,SO3在装置 中被吸收,装置D中盛放的溶液是: 。
(3)实验结束后,为使装置中残留的SO2、SO3被充分吸收,操作方法是
(4)有人设想用如图所示装置,根据电化学原理将SO2转化为重要的化工原料。A为SO2,B为O2,则负极是 (填左、右),负极的电极反应为 ;一段时间后,溶液的pH变 。

[广东卷]氟乙酸甲酯是一种重要的医药中间体,发生过使人中毒致死的案例。某合成反应如下:Cl-CH2COOCH3+ KF→F-CH2COOCH3 +KCl。该反应的产率等受多种因素的影响,下表是KF的干燥方式对反应的影响:
| 序号 |
KF干燥方式 |
氯乙酸甲酯转化率/% |
氟乙酯甲酯收率/% |
| ① |
未干燥 |
41.2 |
30.9 |
| ② |
真空干燥3h |
61.6 |
55.7 |
| ③ |
真空干燥5h |
77.5 |
73.0 |
| ④ |
600℃烘8h |
71.3 |
63.4 |
| ⑤ |
600℃烘12h |
79.2 |
70.7 |
| ⑥ |
600℃烘8h再150℃真空干燥3h |
90.5 |
82.3 |
各原料价格:ClCH2COOCH3:1.16元/mol,KF:0.85元/mol。
(1)由表可看出,最佳干燥方式为 。(填序号)
(2)影响氟乙酸甲酯收率的因素 。

(3)为提高氟乙酸甲酯收率,应选择的比率是 ,理由是
(4)合适的反应时间是 ,时间不宜过长的原因可能是
(5)写出氟乙酸甲酯完全水解的方程式
下列实验方案中,不能测定CuO和FeO混合物中FeO质量分数的是
| A.取a g混合物在—下与足量H2充分反应,将反应后的气体通过碱石灰,碱石灰增重c g |
| B.取a g混合物在高温下通入足量CO气体,充分反应后,冷却后称得固体质量为c g |
| C.取a g混合物完全溶于稀硝酸中,加入足量铁粉,充分反应后,过滤、洗涤、烘干,固体比加入的铁粉增重b g |
| D.取a g混合物用稀硫酸充分溶解后,加人足量Na2O2粉末,过滤、洗涤、烘干、灼烧,所得固体质量为b g |
下列操作不能达到实验目的的是( )
目的 |
操作 |
|
A |
除去苯中少量的苯酚 |
加入适量NaOH溶液,振荡、静置、分液 |
B |
证明酸性:碳酸>苯酚 |
将盐酸与NaHCO3混合产生的气体直接通入苯酚钠溶液 |
C |
除去碱式滴定管胶管内的气泡 |
将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出 |
D |
配制用于检验醛基的氢氧化铜悬浊液 |
向试管中加入2mL 10% NaOH溶液,再滴加数滴2% CuSO4溶液,振荡 |
A.AB.BC.CD.D
凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知: .
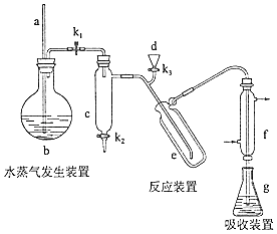
回答下列问题:
(1)a的作用是________.
(2)b中放入少量碎瓷片的目的是________.f的名称是________.
(3)清洗仪器:g中加蒸馏水:打开 , 关闭 、 , 加热b,蒸气充满管路:停止加热,关闭 , g中蒸馏水倒吸进入c,原因是________;打开 放掉水,重复操作2~3次.
(4)仪器清洗后,g中加入硼酸( )和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 , d中保留少量水,打开 , 加热b,使水蒸气进入e.
①d中保留少量水的目的是________.
②e中主要反应的离子方程式为________,e采用中空双层玻璃瓶的作用是________.
(5)取某甘氨酸( )样品m 克进行测定,滴定g中吸收液时消耗浓度为 的盐酸 ,则样品中氮的质量分数为________%,样品的纯度≤________%.
限用一种试液即可区别Na2S、Na2SO3、Na2CO3、NaAlO2、Na2SO4五种溶液。应选用
| A.烧碱溶液 | B.盐酸 | C.氨水 | D.氯化钡溶液 |
根据下列实验操作和现象所得到的结论正确的是( )
选项 |
实验操作和现象 |
结论 |
A |
向淀粉溶液中加适量20% H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 |
淀粉未水解 |
B |
室温下,向0.1mol•L﹣1HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升 |
镁与盐酸反应放热 |
C |
室温下,向浓度均为0.1mol•L﹣1的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀 |
白色沉淀是BaCO3 |
D |
向0.1mol•L﹣1H2O2溶液中滴加0.01mol•L﹣1KMnO4溶液,溶液褪色 |
H2O2具有氧化性 |
A.AB.BC.CD.D
化学与生活、社会密切相关。下列说法不正确的是
| A.纯碱可用于生产普通玻璃,可用纯碱除去物品表面的油污 |
| B.盐卤点豆腐、明矾净水与胶体的性质有关 |
| C.高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 |
| D.H2O2、SO2、O3等都用于织物漂白,它们的漂白原理相同 |
试题篮
()