用pH试纸测定某无色溶液的pH值时,规
范的操作是( )。
| A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 |
| B.将溶液倒在pH试纸上,跟标准比色卡比较 |
| C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 |
| D.在试管内放少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 |
下列行为中符合安全要求的是( )
| A.进入煤矿井时,用火把照明 |
| B.节日期间,在开阔的广场燃放烟火爆竹 |
| C.用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D.实验时,将水倒入浓硫酸配制稀硫酸 |
聚合硫酸铁(PPS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原成Fe2+。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______________。
a.容量瓶 b.烧杯 c.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_____________________________。
a.控制溶液中Fe2+与Fe3+含量比 b.确定下一步还原所需铁的量
c.确定氧化Fe2+所需NaClO3的量 d.确保铁的氧化物酸溶完全
(3)聚合硫酸铁溶液中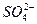 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中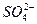 与Fe3+物质的量之比。测定时所需的试剂为__________________,需要测定______________和______________的质量。(填写化合物的化学式)
与Fe3+物质的量之比。测定时所需的试剂为__________________,需要测定______________和______________的质量。(填写化合物的化学式)
a.NaOH b.FeSO4 c.BaCl2 d.NaClO3
今有Ba(NO3)2、AgNO3、Fe(NO3)3的混合液,欲将Ba2+、Ag+、Fe3+
分离,分别得到三种元素的不溶物,按下图所示实验:
(1)加入的试剂(写化学式):X______,Y______,Z______。生成的沉淀(写化学式):A______,B______,C______。
(2)写出反应①②③的离子方程式:①____________,②____________,③____________。
实验室下列物质的保存方法中,不正确的是
| A.新制的氯水保存在棕色瓶中,并放在阴凉处 |
| B.氢氧化钠溶液盛放在配有玻璃磨口塞的试剂瓶中 |
| C.少量的金属钠保存在煤油中 |
| D.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |
有A、B、C、D四种无色溶液,它们分别是Na2CO3、Na2SO4、H2SO4、BaCl2中的某一种,为确定各是何种溶液,进行以下实验:(1)A+B→溶液+气体;(2)C+D→溶液+沉淀;(3)B+D→溶液+沉淀(X);(4)A+D→溶液(Y)+沉淀;(5)沉淀(X)+溶液(Y)→溶液+气体。
由以上实验可知A为________,B为________,C为________,D为________。
请写出有关的化学方程式:
(1)___________________________
(2)_________________________ (3)________________________
(4)_________________________ (5)________________________
下列实验操作中错误的是( )
| A.蒸馏操作时,先得到的少量液体可能会与器壁等接触而含杂质较多,可以弃掉 |
| B.分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液 |
| C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| D.萃取分液后,要得到被萃取的物质,通常还要进行蒸馏,为了更好的控制温度,用水浴加热比直接加热要好 |
溶质质量分数分别为a%和5a%的H2SO4溶液按等体积混合,混合溶液中H2SO4的质量分数为( )
| A.3a% | B.6a% | C.>3a% | D.<3a% |
除去下列溶液中的杂质(括号内的物质),下列做法不正确的是( )
| A.NaCl溶液(BaCl2),加Na2SO4溶液,过滤 |
| B.KNO3溶液(AgNO3),加NaCl溶液,过滤 |
| C.NaCl溶液(I2),加酒精,分液 |
| D.KNO3溶液(I2),加四氯化碳,分液 |
(9分)氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO)能使氧化铜溶解。请你和他一起通过如图所示的Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
(1)某同学提出的假设是____________________________________________________。
(2)通过实验Ⅰ可以证明___________________________________________________。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入________,再加入________。
(4)探究结果为______________________。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是________。
如下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )

| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
电制法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42―杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下: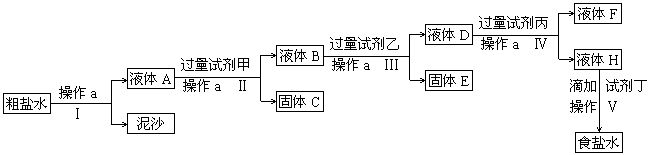
请回答以下问题:
(1)操作a的名称是____________,所用玻璃仪器是________________________________。
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为________溶液。
(3)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式________________。
20℃时,在100 g水中溶解11.1 g K2SO4恰好达到饱和,此饱和溶液的密度为1.08 g·cm―3。若将350 mL此温度下K2SO4饱和溶液用水稀释至500 mL。计算稀释后溶液中K2SO4的物质的量浓度。
试题篮
()