碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,c电极表面先有红色物质析出,后有气泡产生 |
| D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9~3.8。常温下,酒石酸(用H2T表示)水溶液中三种微粒所占的分数(a)与pH的关系如图所示。下列表述不正确的是
| A.葡萄酒中除了存在酒石酸外,还存在酒石酸盐 |
B.常温下, |
| C.当葡萄酒的pH为3.7时,HT一所占分数达到最大,此时葡萄酒中H2T>T2- |
| D.当HT一和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是
| A.还原性:I->Fe2+>Br- |
| B.原混合溶液中FeBr2的物质的量为6 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
常温下取金属钠、铝、铁各1克,加入1mol/L的硫酸V升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是
| A.V≥1/18 | B.V≤1/23 | C.V<1/18 | D.V≤1/56 |
下列说法正确的是
| A.一定温度下,10mL 0.50mol·L-1 NH4Cl溶液与20mL 0.25mol·L-1 NH4C1溶液含NH4+物质的量相同 |
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3·H2O的电离常数 |
C.一定温度下,已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO- +H+,加少量烧碱溶液可使溶液中 CH3COO- +H+,加少量烧碱溶液可使溶液中 值增大。 值增大。 |
| D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
现有室温下四种溶液,有关叙述不正确的是
| 编号 |
① |
② |
③ |
④ |
| pH |
10 |
10 |
4 |
4 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va + Vb),若混合后溶液pH = 5,则Va : Vb =" 11" : 9
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色),①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+
2H++ 2CrO42-(黄色),①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ 2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
| A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
| B.实验②能说明氧化性:Cr2O72-> Fe3+ |
| C.CrO42-和Fe2+在酸性溶液中可以大量共存 |
| D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9~3.8。常温下,酒石酸(用H2T表示)水溶液中三种微粒所占的分数(a)与pH的关系如图所示。下列表述不正确的是
| A.葡萄酒中除了存在酒石酸外,还存在酒石酸盐 |
B.常温下,H2T H++HT- Ka=10-3 H++HT- Ka=10-3 |
| C.当葡萄酒的pH为3.7时,HT一所占分数达到最大,此时葡萄酒中H2T>T2- |
| D.当HT一和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32–、SO42–、Cl–、NO3–中的若干种。若在该溶液中逐滴加入稀盐酸至过量无明显现象,并得到X溶液,对X溶液进行如下实验:(已知该题忽略水的电离,且原溶液中各离子浓度均为0.5mol·L-1)。
下列结论正确的是
| A.原溶液中可能含有NO3–和Al3+ |
| B.白色沉淀C可能是Al(OH)3 |
| C.原溶液中一定存在NH4+、Fe2+、SO42–、Cl– |
| D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物 |
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是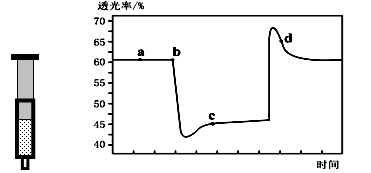
| A.b点的操作是拉伸注射器 |
| B.d点:v(正)< v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为 ,以邻苯二酚为原料合成迷迭香酸的路线为
,以邻苯二酚为原料合成迷迭香酸的路线为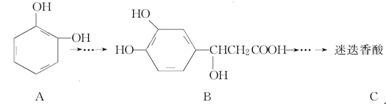
下列说法正确的是
| A.有机物B可以发生取代、加成、消去、氧化反应 |
| B.有机物A分子中所有原子一定在同一平面上 |
| C.有机物C在浓硫酸催化下水解的一种产物是B |
| D.1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应[A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
| A.30min时降低温度,40min时升高温度 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.8min前A的平均反应速率为0.08mol/(L•min) |
| D.30min~40min间该反应使用了催化剂 |
室温下,下列溶液中粒子浓度大小关系正确的是
| A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① |
| C.0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
下列有关化学用语表示正确的是
①乙烯的最简式:CH2=CH2
②对甲基苯甲醇的结构简式:
③Cl-的结构示意图:
④甲烷分子的球棍模型:
 ⑤羟基的电子式:
⑤羟基的电子式: 
⑥原子核内有20个中子的氯原子:
⑦HCO3-的水解方程式为:HCO3-+H2O CO32-+H3O+
CO32-+H3O+
⑧ 的名称:1,3二甲基2丁烯
的名称:1,3二甲基2丁烯
| A.①④ | B.④⑤ | C.③⑦ | D.②⑧ |
在含有0.6molCl-、0.8 molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则
A.x= |
| B.x的取值范围是0<x<11/32 |
| C.A点横坐标的值随x发生变化 |
| D.若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
试题篮
()