浅黄色粉末A跟无色液体B反应有无色气体C产生,金属D在C中燃烧可生成A,D跟B反应放出气体E,E和C又化合为B。从以上实验现象可判断(用化学式填空):
(1)A ,B ,C ,D ,E ;
(2)A与B反应的化学方程式为 ,此反应中 是氧化剂, 是还原剂;
(3)金属D在C中燃烧的化学方程式为 ,D与B反应的离子方程式为 。
(1)鉴别NaCl溶液和Na2CO3溶液的试剂是_________,离子方程式为____________________。
(2)除去混在NaCl溶液中少量NaHCO3杂质的试剂是________,离子方程式为 ______。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用________方法,化学方程式为______________________。
现有常温下的六份溶液:
①0.01mol • L﹣1 CH3COOH溶液;
②0.01mol • L﹣1 HCl溶液; ③pH=12的氨水; ④ pH=12的NaOH溶液;
⑤0.01mol • L﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01mol • L﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②________③(填“>”“<”或“=“)。
(3)将六份溶液同等稀释10倍后,溶液的pH:①________②,③________④,⑤______⑥(填“>”“<”或“=“)。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
(1)PH=10的Na2CO3溶液、NaOH溶液和PH=4的NH4Cl溶液、HCl溶液中水的电离程度的大小关系是 。(用化学式表示)
(2)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(3)NH4HSO4的电离方程式为
目前,市场上经常用甲醇碱性燃料电池做为手机的电池,该电池的储电量可长达一个月,非常适合通话量比较高的人群,请写出该燃料电池的正极电极反应: 和负极电极反应: 。
(1)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度。
①盛装0.2000 mol/L盐酸标准液应选用的滴定管是_________(填字母序号)。
②当接近滴定终点时,很少量的碱或酸就会引起溶液的 突变。
③有关数据记录如下:
| 实验编号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| I |
20.00 |
0.50 |
20.70 |
| II |
20.00 |
6.00 |
26.00 |
| III |
20.00 |
1.40 |
21.20 |
根据数据计算NaOH溶液的物质的量浓度是______________mol/L。
④若只用蒸馏水冲洗锥形瓶,则测定结果_________(填“无影响”.“偏高”或“偏低”)。
(2)25℃,将一元酸HA溶液和NaOH的溶液等体积混合,两种溶液的浓度和混合后溶液的pH见下表:
| 实验编号 |
c(HA)/mol﹒L-1 |
c(NaOH)/mol﹒L-1 |
混合溶液的pH |
| I |
0.2 |
0.2 |
pH=a |
| II |
c1 |
0.2 |
pH=7 |
| III |
0.2 |
0.1 |
pH>7 |
| IV |
0.1 |
0.1 |
pH=9 |
请回答:
①不考虑其它组实验结果,单从I组实验情况分析,若a_____7(填“>”“<”或“=”),则HA为强酸。
②在II组实验的混合溶液中,c(A-)______ c(Na+)(填“>”“<”或“=”)。
③不考虑其它组实验结果,单从III组实验情况分析,HA是_____酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:_________________,____________________。
④IV组实验的混合溶液中,由水电离出的c (OH-)=___________。
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
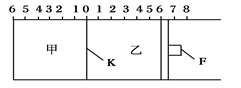
(1)达到平衡后隔板K是否可能处于0刻度_______(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(2)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为__ __mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度________处(填下列序号:①<6 ②>6 ③=6)。

(3)若一开始就将K、F固定,其他条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲________乙(填“>”、“<”或“=”);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于________。
(4)平衡后将甲容器的混合气的1.0%通入足量Ba (NO3)2溶液,生成的BaSO4质量为________g。
(现有下列6种物质:①稀豆浆 ②K2CO3溶液③Cl2 ④SO2 ⑤稀盐酸 ⑥氢氧化钠。其中属于胶体的是 (填序号、下同),属于非电解质的是 ,属于单质的是 ,属于电解质的是 。KHCO3的电离方程式是 。
某溶液A中可能含有NH4+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、SO42-中的几种离子,且溶液中各离子的物质的量浓度均为0.1mol.L-1。现取该溶液进行如下实验:

(1)溶液A中一定不存在的离子为____________________________(填离子符号)。
(2)溶液A中加入(NH4)2CO3,生成白色沉淀甲和气体甲的原因是 。
(3)白色沉淀乙的成分为____________________________(填化学式)。
(4)为了进一步确定溶液A中是否含有NH4+,另取10ml该溶液,向其中滴加NaOH溶液,沉淀的物质的量随NaOH溶液体积(mL)的变化如右图所示。据图回答:

①溶液A中______________(填“含有”或“不含有”)NH4+。
②所加NaOH溶液的物质的量浓度为______________mol.L-1 。
③若在A溶液中改加10ml0.2mol.L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______________mol。
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

元素R在周期表中的位置是________________________。
元素Y和W形成的Y2W2型化合物中含有化学键的类型为_____________。
测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为______________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
下列能说明碳、硫两种元素非金属性相对强弱的是____________(填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
①羰基硫(COS)的电子式为:______________。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为______________;若气体a为单质,反应II的离子方程式为________________________________________________。
化学与社会经济建设、生态文明建设、人类健康保障等密切相关。
(1)材料是经济和生态文明建设的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是 。
②橡胶是制造轮胎的重要原料,橡胶属于 (填字母)。
A.金属材料 B.无机非金属材料 C.有机高分子材料
③钢铁制品在潮湿的空气中能发生 腐蚀。发生该腐蚀时的负极反应式为 。
(2)防治环境污染,改善生态环境已成为全球共识。
①2013年,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是 (填字母);
A.O2 B.CO2 C.PM2.5
②采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾.
A.废电池 B.易拉罐 C.玻璃瓶
在焚烧处理前,除废电池外,还有 (填字母)应剔除并回收,随意丢弃电池造成的主要危害是 。
③漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是 。
(3)保证食品安全、保持营养均衡,是保障人体健康的基础。
①维生素C能促进人体生长发育。下列富含维生素C的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
②缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是
A.碘 B.铁 C.钙
③人体内蛋白质在蛋白酶作用下,水解为 ,在鸡蛋清溶液中加入饱和硫酸铵溶液有沉淀析出的过程称为 。
④使用青霉素可能会产生过敏,在用药前患者一定要进行 。
Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 = 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。

(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续地生产。请回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则NH3催化氧化生成NO和H2O(g)的热化学反应方程式可表示为: 。
(2)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
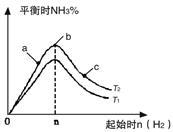
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是 。
②在起始时体系中加入N2的物质的量为1mol。若容器容积
为2L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
③图像中T1和T2的关系是:T1 T2。(填“>”“<”“=”“无法确定”)
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图):

4NH3+5O2 4NO+6H2O ;
4NO+6H2O ;
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内NO2的生成速率可表示为____________________。
②下列情况能说明该反应已达平衡状态的是 。
A.单位时间内生成2mol NO2的同时消耗了lmol N2O5 B.混合气体的颜色不再发生变化
C.混合气体的密度保持不变 D.在绝热恒容的容器中,反应的平衡常数不再变化
CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2·6H2O的工艺流程如下:
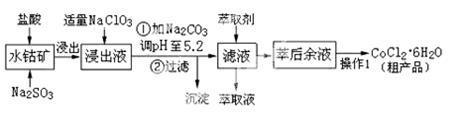
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式_______________________;
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________。
(3) “操作1”中包含3个基本实验操作,它们依次是_______________、________________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为 。
(5)萃取剂的作用是 。
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是________________。
镁合金是重要的民用和航空材料,镁作为一种强还原剂,还用于钛、镀和铀的生产,氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。
(1)氧化镁的电子式为________。
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式____________________。
(3)从海水中提取金属镁用到的主要化学药品有________________。
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2·6H2O,其流程如下:
已知:I卤块主要成分为Mg Cl2·6H2O,含有MgSO4、FeCl2等杂质。Ⅱ可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
①加入BaCl2溶液的目的是____________。
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为__________。
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:________________________________________.
试题篮
()