已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和单质碘反应生成1 mol HI需要 (填“放出”或“吸收”) k J的热量。
下表为元素周期表中的一部分,列出了10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 第2周期 |
|
|
|
⑥ |
|
⑦ |
|
|
| 第3周期 |
① |
③ |
⑤ |
|
⑧ |
|
⑨ |
⑩ |
| 第4周期 |
② |
④ |
|
|
|
|
|
|
(1)10种元素中,化学性质最不活泼的是 ;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是 ,(填化学式)该物质内部含有的化学键类型是 和 ;
(3)元素⑦的氢化物的化学式为 ;该氢化物常温下和元素②的单质反应的化学方程式 ;
(4)③和⑨两元素形成化合物的电子式是 ;①和⑦两元素形成四核化合物的电子式是 ,该物质与CO2反应的化学方程式为 ;
(5)①和⑤最高价氧化物对应水化物相互反应的离子方程式为:
。
X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布。H2在X单质中燃烧,产生苍白色火焰;Y元素的气态氢化物是H2Y,其最高价氧化物中Y的质量分数为40%;Z元素和氮元素在同一族。
(1)根据以上条件,推断X ,Y ,Z (填写元素名称);
(2)写出它们的最高价氧化物的水化物的化学式X ,Y ,Z 。
工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HClO→CH2(OH)CH2Cl。以乙烯为原料制取PVC等产品的转化关系如图所示。
试回答下列问题:
(1)写出有机物B和G的结构简式:B____________,G_________;
(2)②、⑤、⑦的反应类型分别是_______________,_____________,________________;
(3)写出D的一种同分异构体的结构简式_____________;
(4)写出反应⑥的化学方程式__________________________________;
(5)E的核磁共振氢谱有三个峰,峰面积之比为:______________(由小到大)。
(6)写出C与D按物质的量之比为1∶2反应生成H的化学方程式:
______________________________________________________________;
实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。化学小组主要选用了下列药品和仪器进行实验(铁架台等固定仪器未画出)。按气流由左向右的方向,仪器连接顺序是 。回答以下问题:
。回答以下问题:
(1)A中加入硫酸溶液的仪器名称是: 。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,排除装置中原有的空气。加酸后A装置再次鼓入空气的作用是 。
(3)E装置的作用是 。
(4)实验中,要确保实验中C瓶溶液不褪色,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为 。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
| A |
单质在自然界中硬度最大 |
| B |
原子中s能级与p能级电子数相等且有单电子 |
| C |
C在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
| D |
单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E |
单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物 |
(1)常温下,某气态单质甲分子与AB分子互为等电子体,则一个甲分子中包含 个π键。
(2)关于B的氢化物,中心原子的杂化类型是 ,分子的空间构型 ,其
熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是 。
(3)D元素原子核外有 种运动状态不同的电子。当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为: 。
(4)E元素基态原子的价电子排布式 。E晶体中微粒的堆积方式是
。
(1)下列各组中,属于同分异构体的是______;肯定属于同系物的是______; (填编号)
① ②
② 
③ C3H6与C4H8 ④ CH3OH与C5H11OH
(2)下图是一种分子式为C3H6O2的有机物的红外光谱谱图,则该有机物的结构简式为:

(3)由苯和必要的试剂五步可合成 ,其过程如下:
,其过程如下:
写出后四步反应的方程式:
①___________________________________________________;
②___________________________________________________;
③___________________________________________________;
④___________________________________________________。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
| 氢气体积(mL) |
50 |
120 |
224 |
392 |
472 |
502 |
(1) 哪一时间段(填0~1、1~2、2~3、3~4、4~5、5~6 min)反应速率最大 ,原因是 。
(2)哪一段时段的反应速率最小 ,原因是 。
(3)第3 ~ 4分钟时间段以盐酸的浓度表示的该反应速率(设溶液体积不变)是 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是 。
A.蒸馏水 B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
I.A是化学实验室中常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
(1)写出A的化学式
(2)写出下列反应的化学方程式
反应①:
反应③:
反应④:
(3)比较反应①与钠和水反应的现象有什么相同和不同
相同点:
不同点:
A~D为短周期元素,其性质或结构信息如下表所示:
| 元素 |
A |
B |
C |
D |
| 相关 信息 |
其单质是一种本身有毒又可用来消毒的有色气体 |
其单质既有金属性,又有一定的非金属性(但属于金属) |
其最外层电子数是电子层数的2倍,且能形成熔点高硬度大的稳定单质 |
其简单离子核外电子层结构与Ar原子电子层结构相同,单质常出现在火山喷口附近或地壳的岩层里 |
请根据表中信息回答下列问题:
(1)A元素在元素周期表中的位置是________,能说明A单质与D单质氧化性相对强弱的离子方程式为__________________________。
(2)B的单质与大多数同类的物质相比较在化学性质上有一些不同之处,请说明其中一点(用文字或化学方程式表述)__________________________ _。
(3)A与C形成化合物的电子式为______________________。
(4) B和D形成的化合物只能用干法制取,写出该方法的化学方程式___________。
下列为A、B、C、D四种物质的转化关系,a、b为反应条件,
(1)若A为单质,a为点燃,b为催化剂、加热,
① D的化学式为
② 写出B到C的化学方程式 。
(2)若A为气态化合物,a为催化剂、加热,B到C转化不需要条件,
①写出C→D化学方程式 。②写出Cu与D的稀溶液反应的离子方程式 。
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题: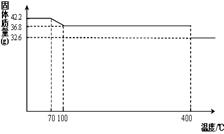
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol•L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;)
(1)已知:
Al和FeO发生铝热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应: 该反应的平衡常数表达式为 。
该反应的平衡常数表达式为 。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”)。
如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后, 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负” ),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放200 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放200 mL 1.0 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
|
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 ②停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 1.28 g,甲烧杯中产生的气体标准状况下体积为 mL 。
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)5000C,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= (用nB、 tB 表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)可逆反应:CO(g)+ 2H2(g) CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混 合气体的密度不再改变的状态
⑤ 混合气体的平均相对分子质量不再改变的状态
(4)改变下列哪些条件能增大甲醇的产量( )
| A.增大容器体积 | B.增大压强 | C.升高温度 | D.加催化剂 |
(5)反应达到平衡后再升高温度,K值 (填“增大”“减小”或“不变”)。
(6)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
试题篮
()